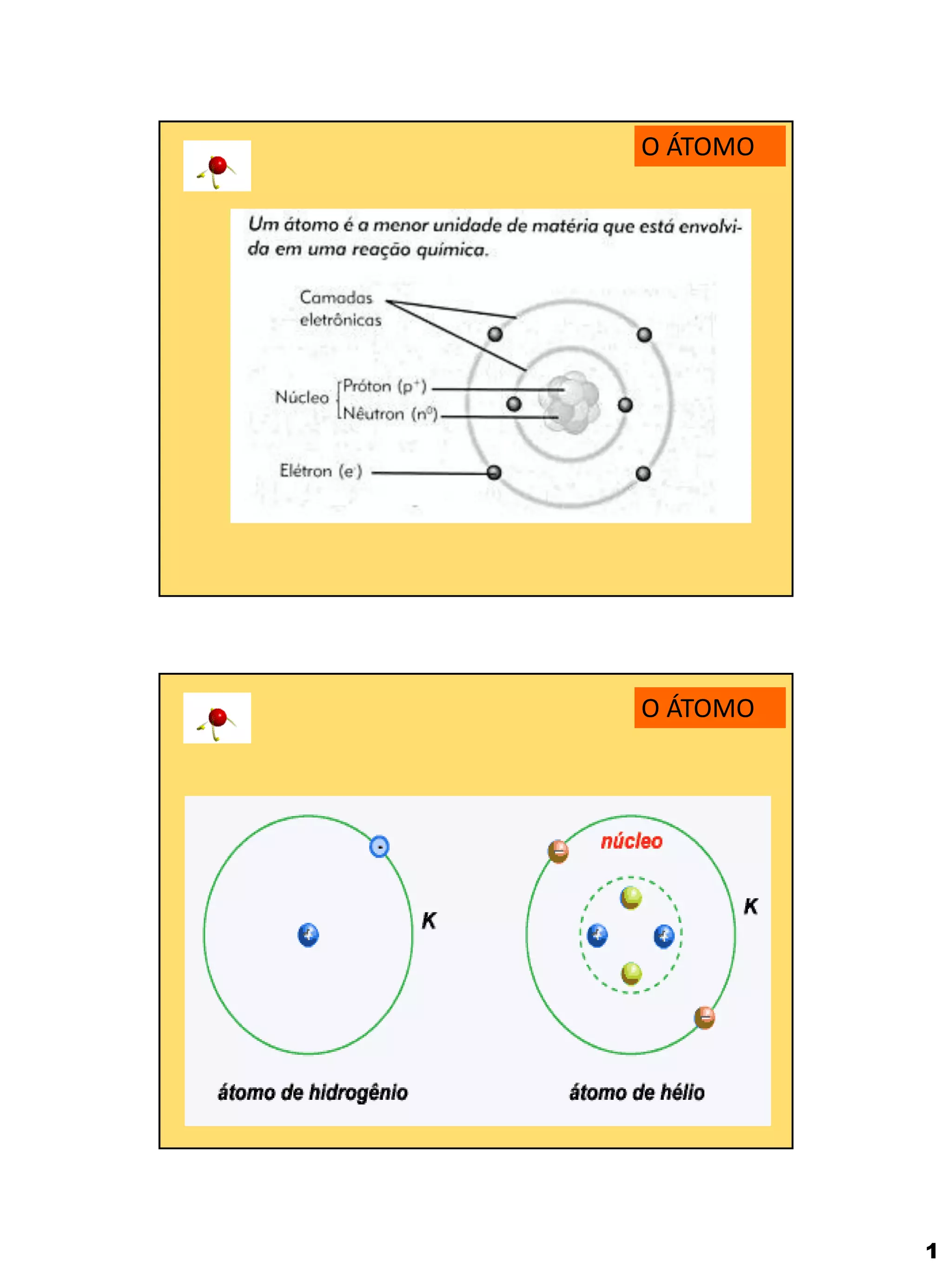
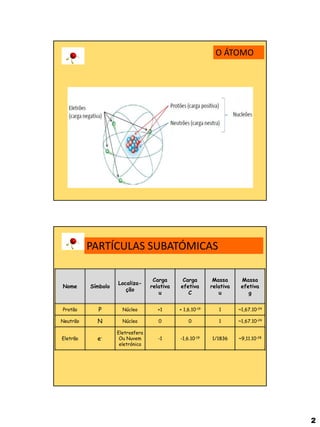
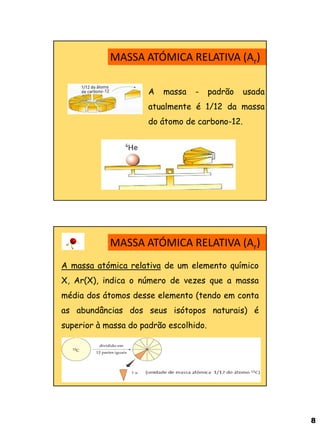
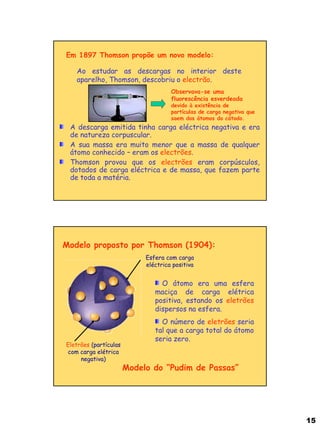
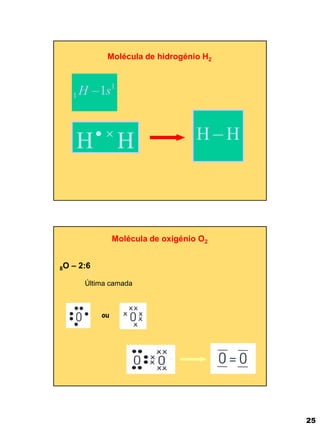
O documento descreve as principais partículas subatômicas (próton, neutrão e elétron) e suas características. Também resume a evolução dos modelos atômicos desde Demócrito até Schrödinger, incluindo as contribuições de Dalton, Thomson, Rutherford, Bohr e Chadwick. Por fim, apresenta informações sobre a notação de Lewis e a dimensão dos átomos.