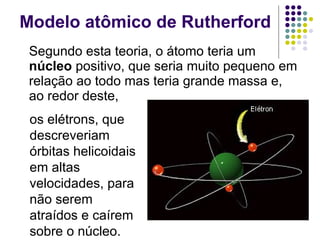
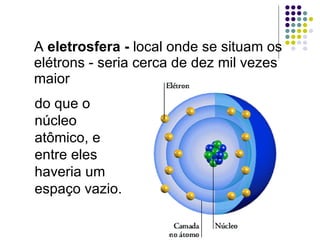
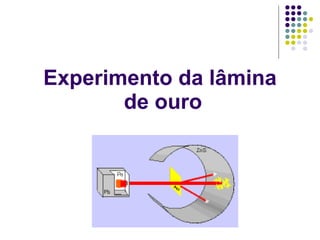
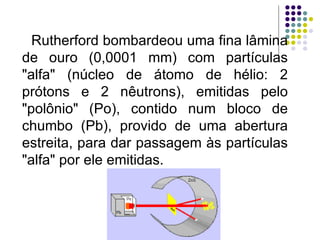
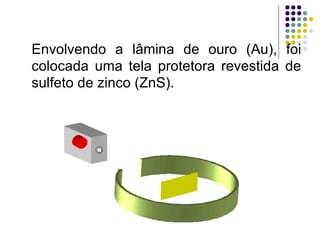
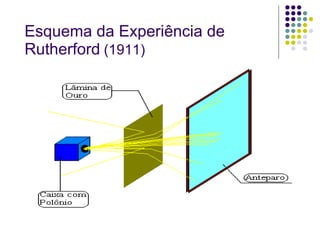
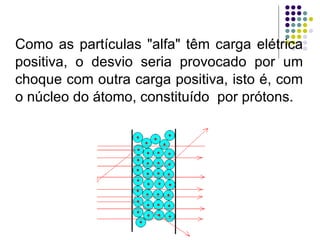
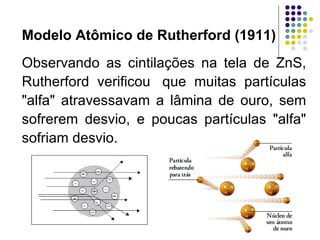
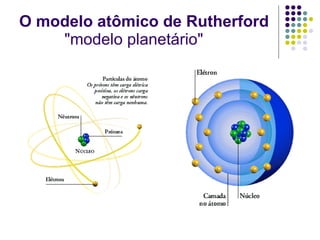
Ernest Rutherford realizou experimentos que levaram ao modelo planetário do átomo, no qual um núcleo denso é cercado por elétrons em órbita. Ele bombardeou uma lâmina de ouro com partículas alfa e observou que a maioria passou direto, enquanto algumas foram desviadas, indicando um núcleo central carregado positivamente. Isso refutou os modelos atômicos anteriores e estabeleceu as bases do moderno entendimento do átomo.