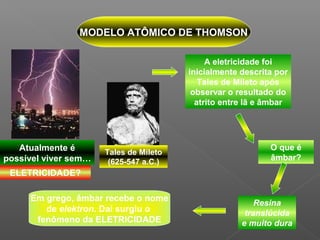
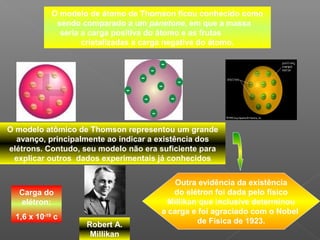
1) O documento descreve o modelo atômico de Thomson, no qual ele propôs que os átomos são esferas com carga positiva e os elétrons estão incrustados neles como "frutas cristalizadas";
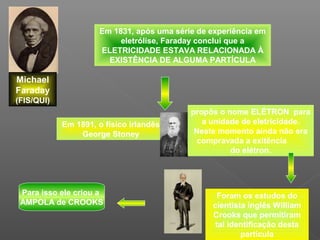
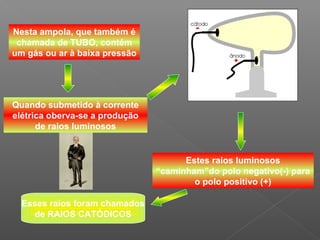
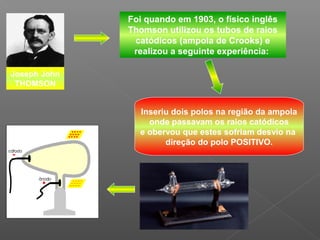
2) Thomson chegou a essa conclusão após experimentos com tubos de raios catódicos, onde observou que esses raios desviavam para polos positivos, indicando carga negativa;
3) Seu modelo representou um avanço ao indicar a existência dos elétrons, mas não explicava outros dados experiment