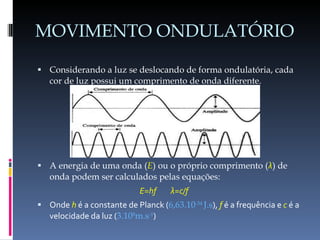
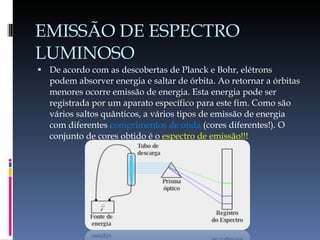
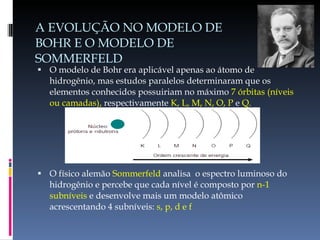
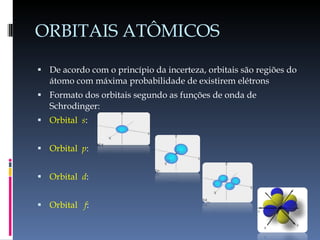
O documento descreve a evolução do conceito de átomo ao longo da história, desde a ideia original dos filósofos gregos até o modelo atômico moderno baseado na mecânica quântica. Aborda os modelos de Dalton, Thomson, Rutherford, Bohr e o desenvolvimento da tabela periódica e da estrutura atômica com base nas descobertas de Planck, Einstein, De Broglie, Heisenberg e Schrödinger.