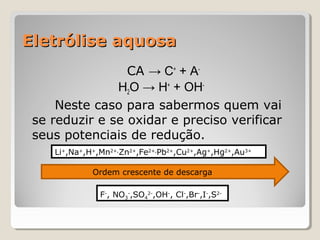
O documento discute conceitos fundamentais de eletroquímica, incluindo:
1) Reações de oxidação e redução, com perda ou ganho de elétrons respectivamente;
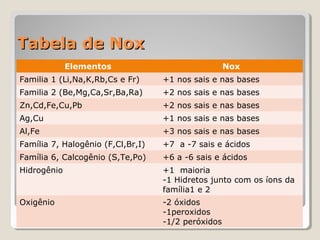
2) Números de oxidação de vários elementos;
3) Pilhas como a pilha de Volta e de Daniell, que geram corrente elétrica através de reações redox.













![Equação de Nernst
E= E° - RT ln Q
nF
R = 8,315 J K-1.mol-1;
T = 298,2 K (25 °C);
F = 96485 C.mol-1 ;
ln= 2,303 log
Substituindo temos:
E= E° -0,059
n
log [P]/[R]](https://image.slidesharecdn.com/eletroqumica-140301191117-phpapp01/85/Eletroquimica-15-320.jpg)