O documento discute conceitos de equilíbrio químico, incluindo:
1) Equilíbrio químico ocorre quando as concentrações de reagentes e produtos permanecem constantes.
2) Reações reversíveis atingem equilíbrio quando as velocidades das reações direta e inversa são iguais.
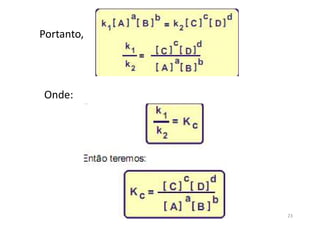
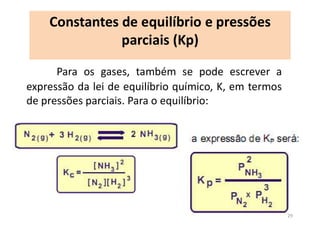
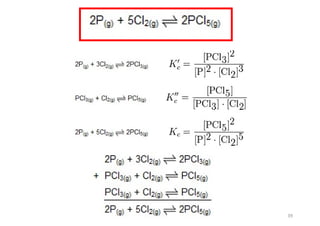
3) Constantes de equilíbrio (K) quantificam o deslocamento do equilíbrio para os produtos ou reagentes.









![• No equilíbrio, tanto de N2O4 reage para formar NO2
quanto de NO2 reage para formar outra vez N2O4:
• A seta dupla significa que o processo é dinâmico.
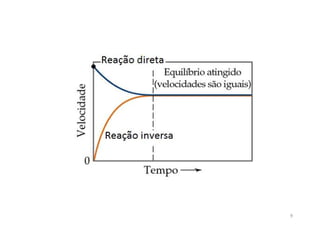
• Considere
Reação direta: A B Velocidade = k[A]
Reação inversa: B A Velocidade = k[B]
• No equilíbrio VA = VB = k[A] = k[B].
N2O4(g) 2NO2(g)
12](https://image.slidesharecdn.com/eqquimico-221213101944-a07d3e18/85/eq-quimico-pdf-12-320.jpg)
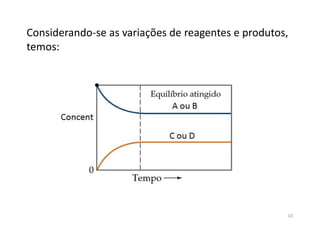
![• Para um equilíbrio escrevemos:
• À medida que a reação progride
– [A] e [B] diminuem para uma constante,
– [C] e [D] aumentam de zero para uma constante.
– Quando [A], [B] e [C], [D] são constantes, o equilíbrio
é alcançado.
– k[A] diminui para uma constante,
– k[B] aumenta de zero para uma constante.
– Quando k[A] = k[B], o equilíbrio é alcançado.
A + B C + D
13](https://image.slidesharecdn.com/eqquimico-221213101944-a07d3e18/85/eq-quimico-pdf-13-320.jpg)





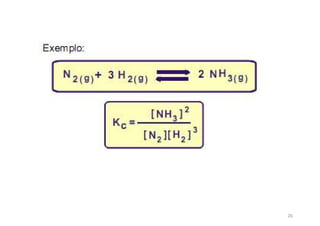
![(v1 e v2 são as velocidades das reações direta e inversa)
Quando se estabelece o equilíbrio químico é possível afirmar
que:
a) [N2] = [H2].
b) [NH3] = constante.
c) [N2] = [NH3].
d) v2 > v1.
e) v1 > v2 .
Considere a reação entre nitrogênio e hidrogênio:
19](https://image.slidesharecdn.com/eqquimico-221213101944-a07d3e18/85/eq-quimico-pdf-19-320.jpg)
![Constantes de equilíbrio
As constantes de equilíbrio, representadas por K,
são determinadas a partir de dados experimentais . Por
conta da análise de uma grande quantidade de dados,
chegou-se a uma expressão genérica para todos os
equilíbrios:
K = [produtos]/[reagentes]
20](https://image.slidesharecdn.com/eqquimico-221213101944-a07d3e18/85/eq-quimico-pdf-20-320.jpg)