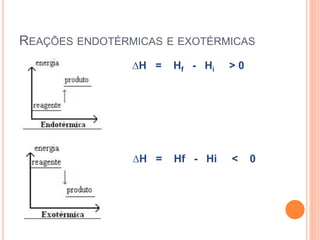
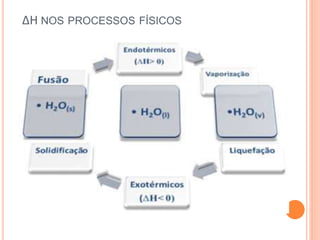
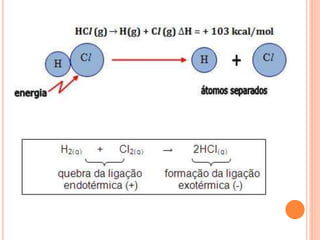
O documento discute os conceitos de calor, energia e variação de entalpia em reações químicas. Explica que calor é transferência de energia entre corpos de diferentes temperaturas e que reações podem liberar ou absorver calor. A variação de entalpia indica a quantidade de calor trocado em uma reação a pressão constante. A lei de Hess estabelece que a variação de entalpia depende apenas dos estados inicial e final.