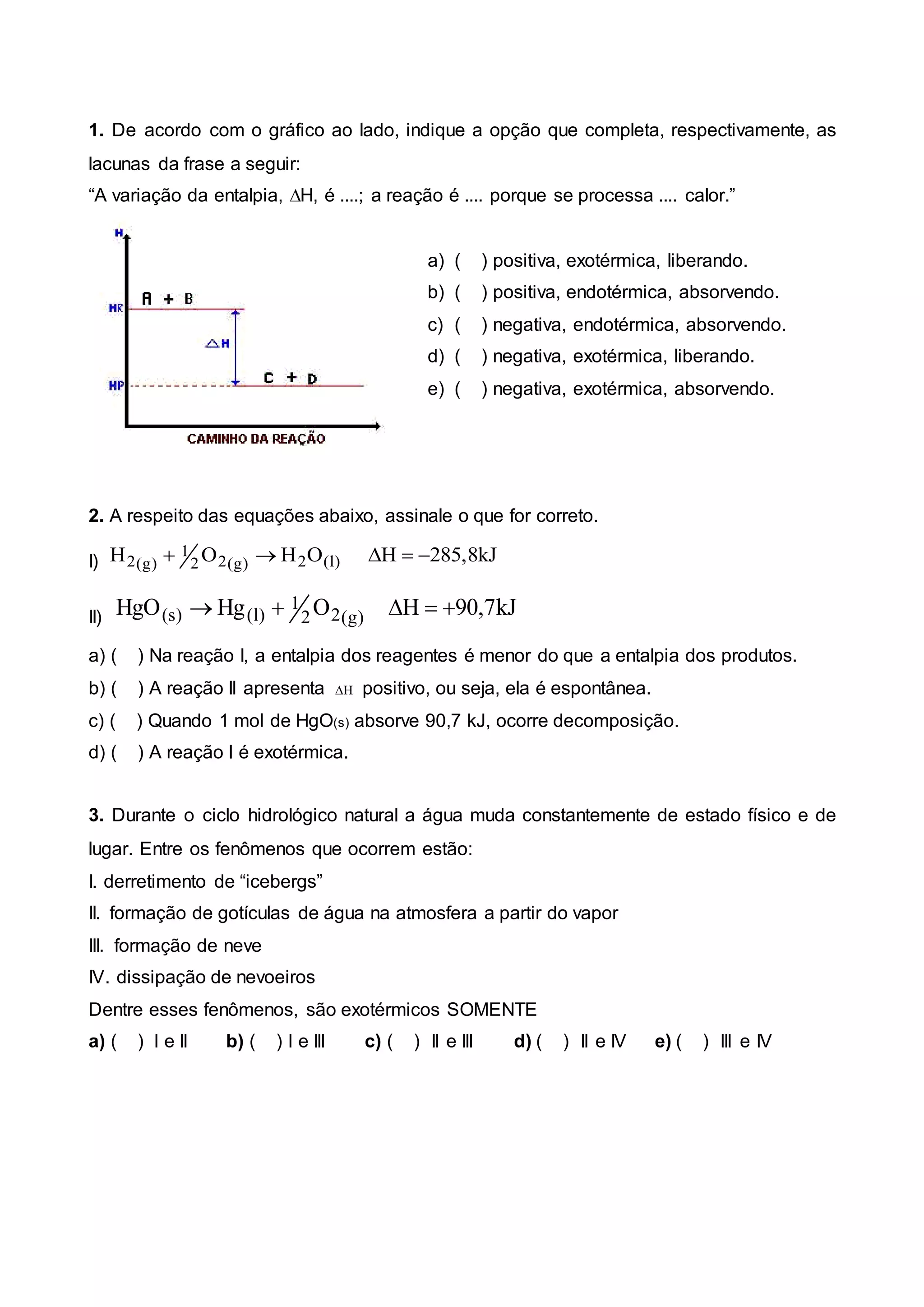
(1) A variação da entalpia, ΔH, é negativa; a reação é exotérmica porque se processa liberando calor.
(2) A reação II apresenta HΔ positivo, ou seja, ela é espontânea.
(3) Os fenômenos exotérmicos são a formação de gotículas de água na atmosfera a partir do vapor e a formação de neve.