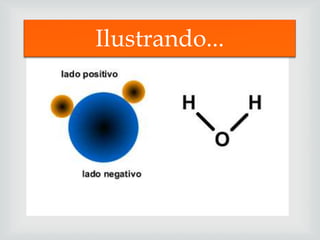
[1] O documento discute vários tipos de soluções comuns, incluindo suas fórmulas e usos, como ácido sulfúrico em baterias de carros e vinagre como tempero de alimentos. [2] Explica conceitos como soluções saturadas, insaturadas e supersaturadas usando cloreto de sódio como exemplo. [3] Discutem-se ainda propriedades de solubilidade de gases e soluções eletrolíticas e moleculares.