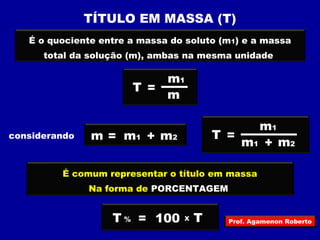
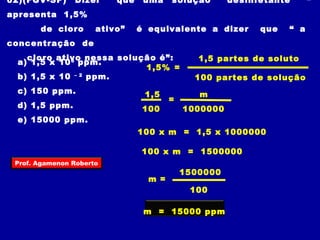
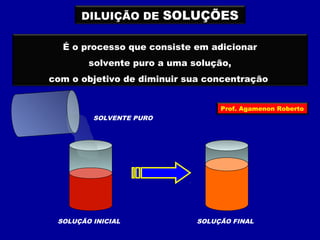
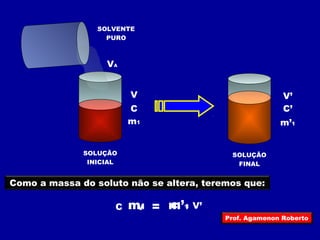
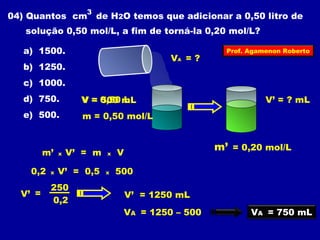
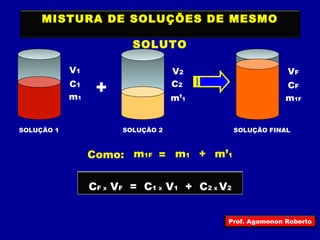
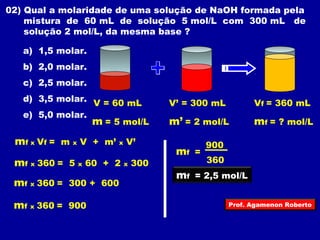
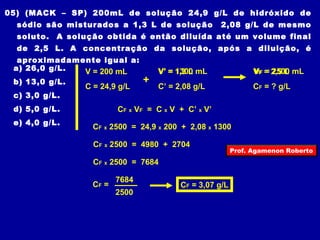
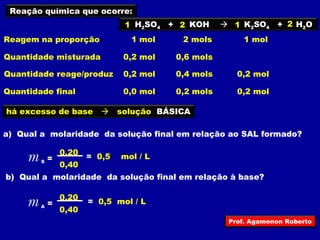
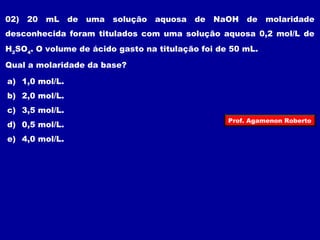
O documento discute conceitos fundamentais sobre soluções químicas, incluindo:
1) A diferença entre misturas homogêneas e heterogêneas;
2) O que é dispersão e as definições de disperso e dispersante;
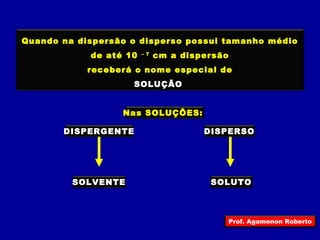
3) Que soluções são um tipo específico de dispersão onde o disperso tem tamanho menor que 10-7 cm;
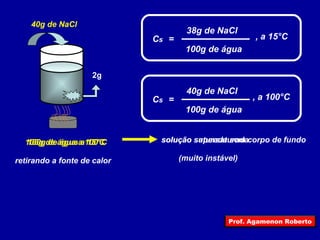
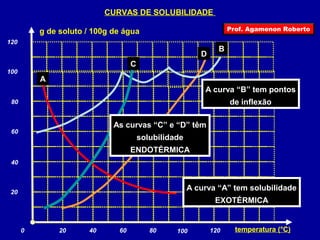
4) Conceitos como solvente, soluto e coeficiente de solubilidade.