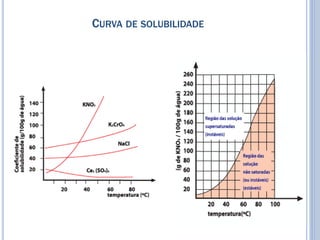
O documento discute conceitos básicos de soluções químicas, incluindo concentração comum. Explica que a concentração é a relação entre a massa do soluto e o volume da solução. Detalha como alterar a concentração de uma solução ao aumentar ou diminuir a quantidade de soluto ou solvente.