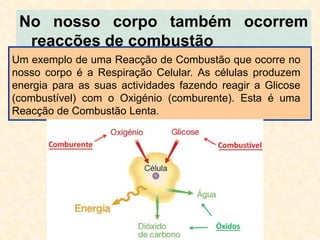
O documento discute vários tipos de reações químicas, incluindo combustão, precipitação e corrosão. Ele explica o que acontece durante cada tipo de reação, fornecendo exemplos como a queima de combustíveis e a dissolução de sais. O documento também aborda como essas reações ocorrem no corpo humano e na natureza, formando cavernas e estalactites/estalagmites.