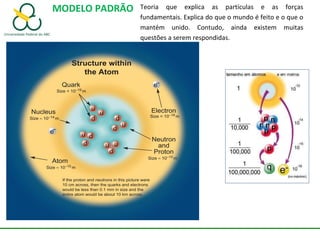
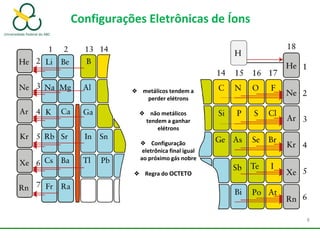
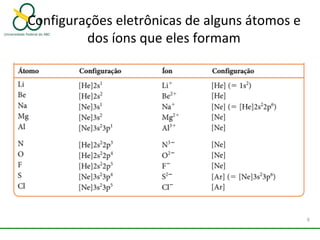
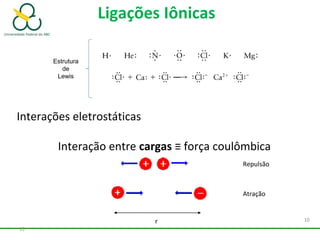
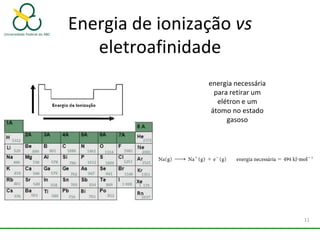
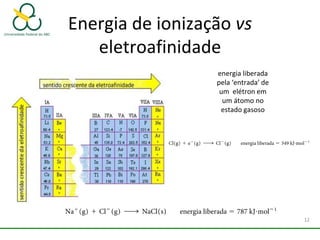
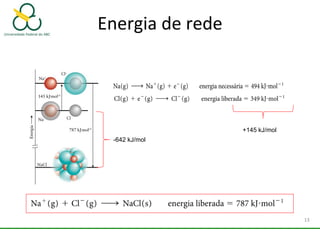
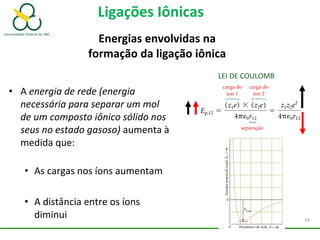
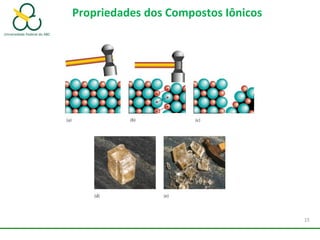
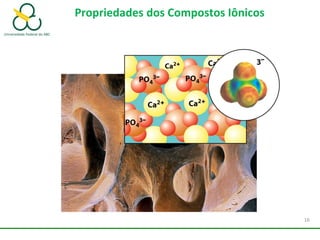
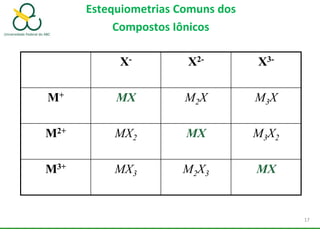
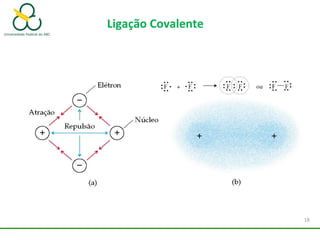
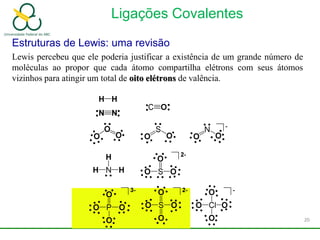
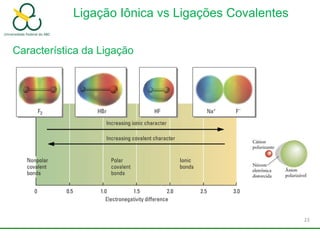
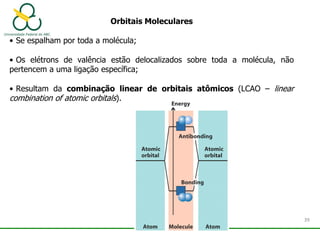
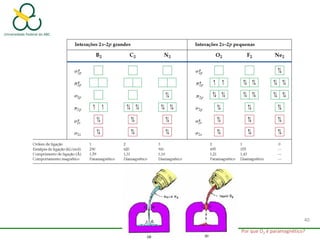
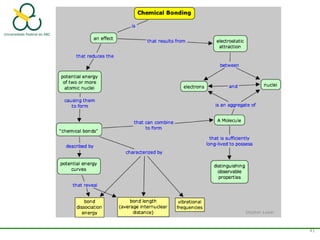
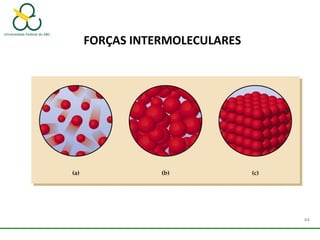
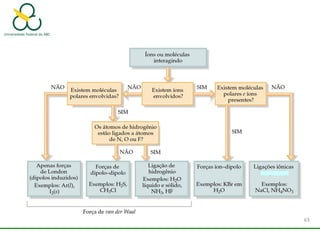
1. O documento discute os diferentes tipos de ligações químicas, incluindo ligações iônicas, covalentes e metálicas.
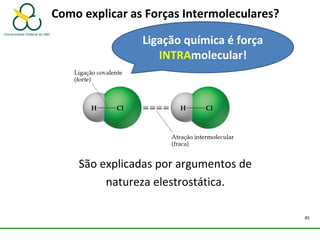
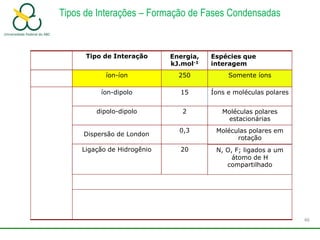
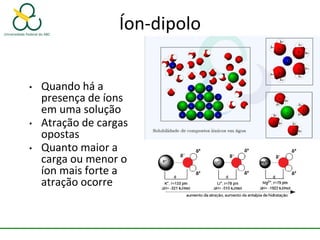
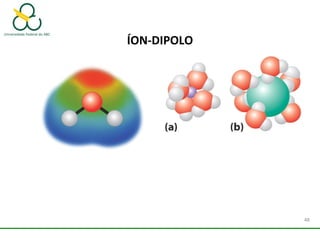
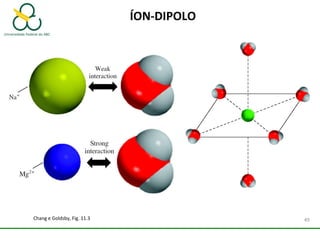
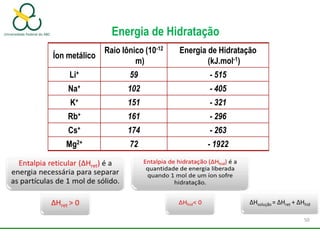
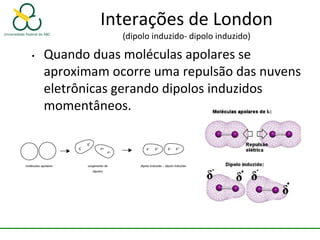
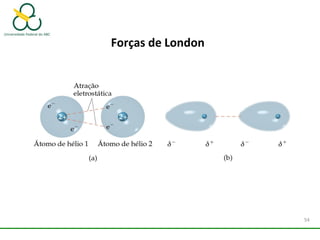
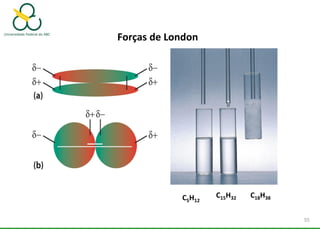
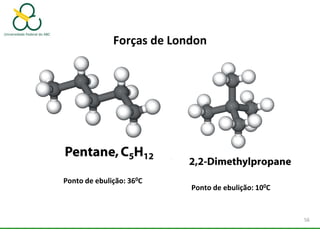
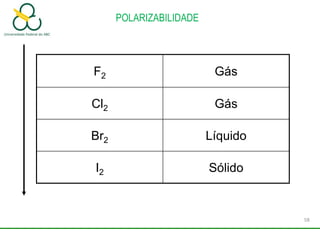
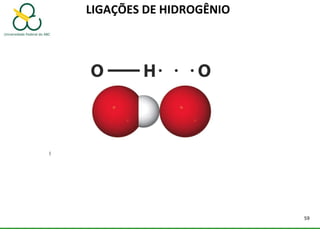
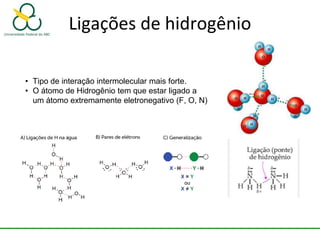
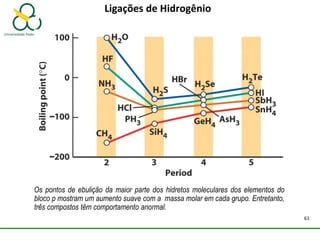
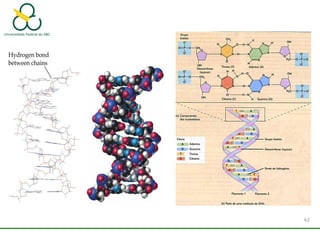
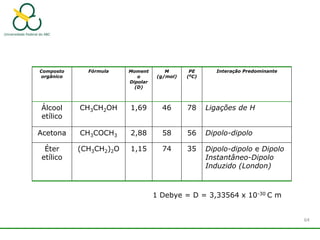
2. Também aborda as forças intermoleculares que mantêm moléculas unidas, como ligação de hidrogênio, interações iôn-dipolo e dipolo-dipolo.
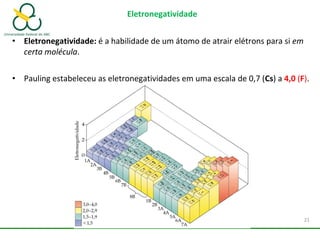
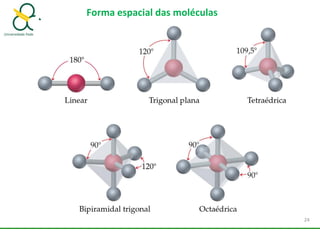
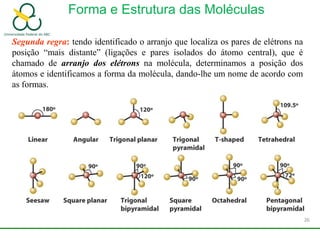
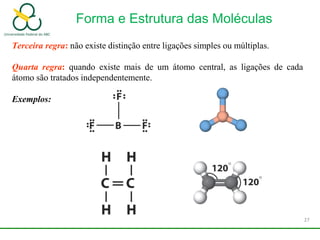
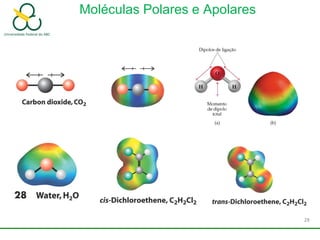
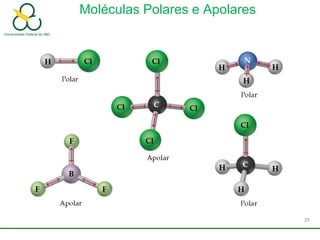
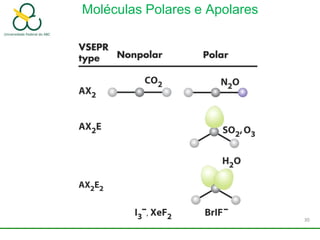
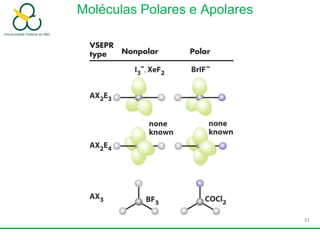
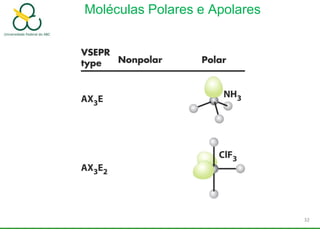
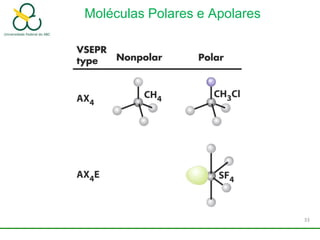
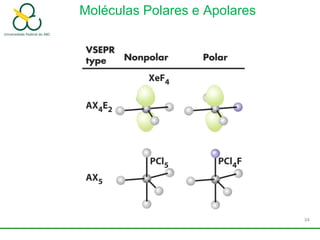
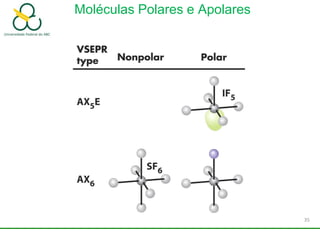
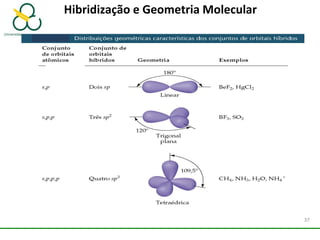
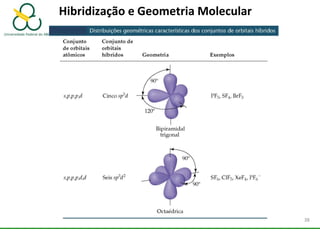
3. Explica como a eletronegatividade, a polaridade e a geometria molecular afetam a estrutura e as propriedades das ligações.