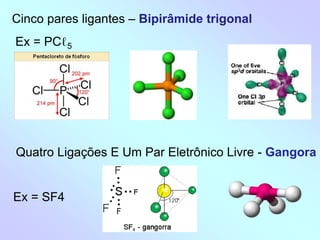
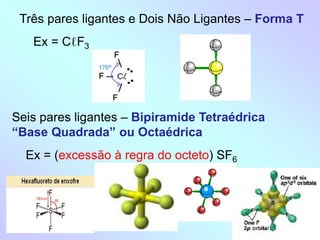
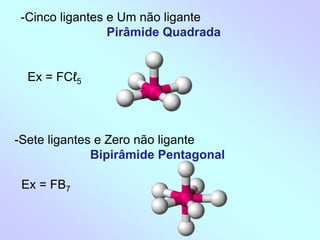
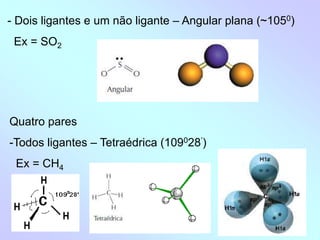
1) O documento discute geometria molecular e como a geometria de uma molécula é determinada pelo número de pares de elétrons ao redor do átomo central.
2) Também discute polaridade de ligações e como ela depende da diferença de eletronegatividade entre os átomos ligados. Ligação polar forma um dipolo elétrico.
3) Explica como a polaridade da molécula depende da polaridade das ligações e geometria molecular, formando um momento dipolar resultante.




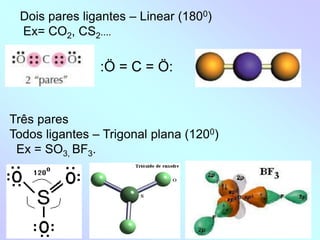
![- Três ligantes e um não ligante – Piramidal (~1070)
Ex = NH3
- Quatro ligantes e dois não ligante – Quadrado Planar
Ex = [Cu(NH3) 4]2+](https://image.slidesharecdn.com/aula4geometriamoleculareforasintermoleculares-230312235528-59cb2d9e/85/Aula_4_-Geometria-molecular-e-forcas-intermoleculares-ppt-7-320.jpg)