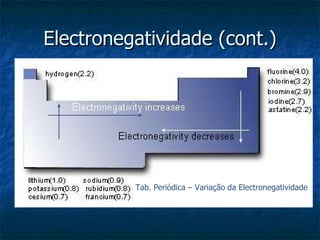
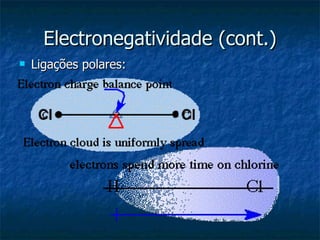
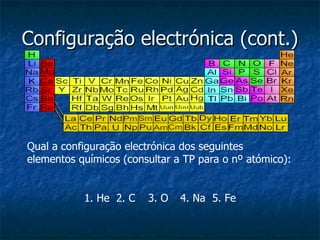
O documento discute o conceito de electronegatividade e sua variação na tabela periódica. Explica que quanto mais electronegativo for um átomo, mais polar será a ligação química. Também aborda a configuração electrónica dos átomos e a ionização de grupos funcionais em meio aquoso.