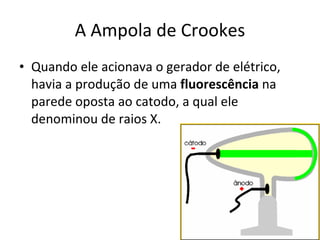
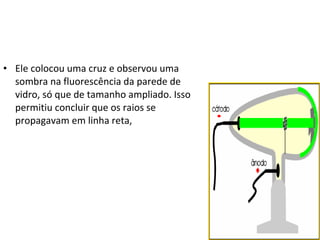
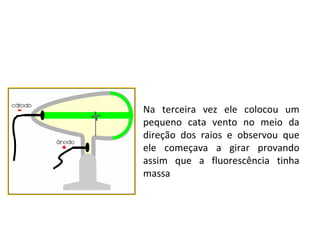
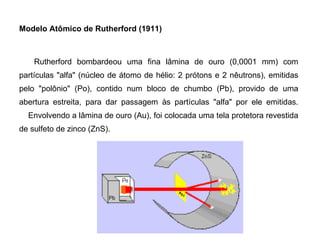
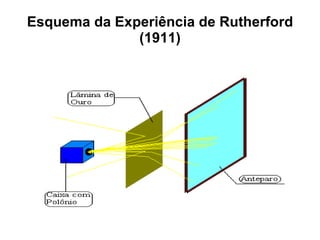
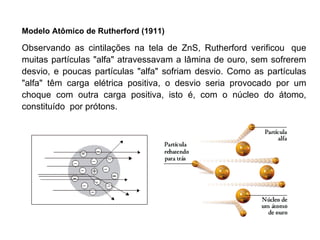
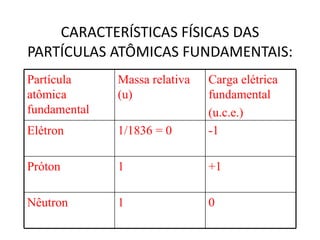
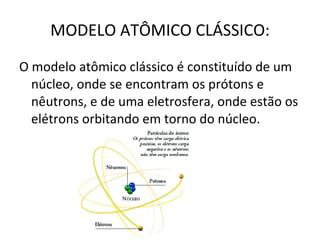
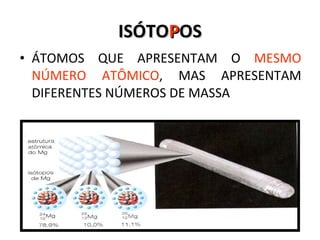
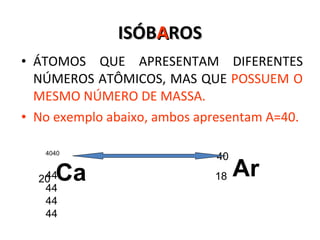
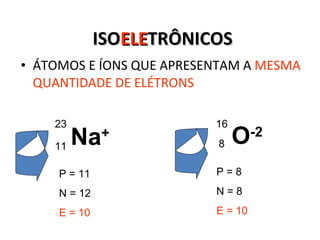
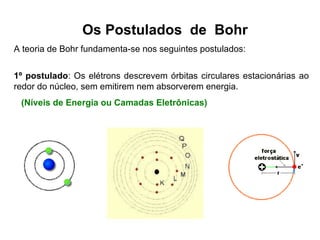
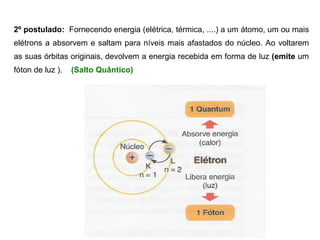
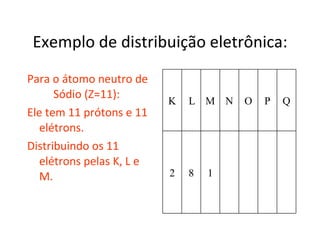
O documento descreve a evolução dos modelos atômicos desde a antiguidade até Niels Bohr. Começa com as primeiras ideias de Demócrito e Aristóteles, passando pelos modelos de Dalton, Thomson, Rutherford, até chegar no modelo atômico de Bohr, que introduziu a mecânica quântica ao explicar o movimento dos elétrons em órbitas quantizadas.