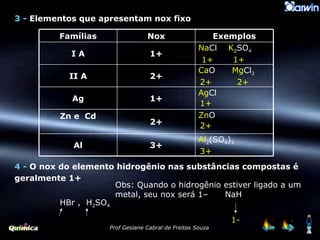
O documento discute o número de oxidação (NOX) e como ele é determinado para diferentes tipos de ligação química. O NOX representa a carga assumida por um átomo quando uma ligação é quebrada. Ele é igual à carga do íon para compostos iônicos e depende da eletronegatividade dos átomos para compostos covalentes. Regras específicas determinam o NOX para diferentes elementos.