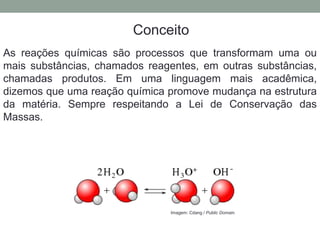
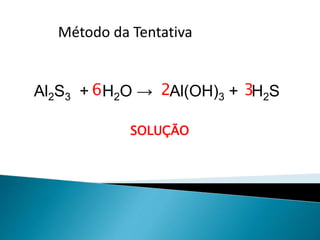
O documento discute métodos para balancear equações químicas, incluindo o método das tentativas, o método algébrico e o método de oxirredução. Apresenta exemplos de equações balanceadas usando esses métodos e regras para determinar os números de oxidação de elementos.