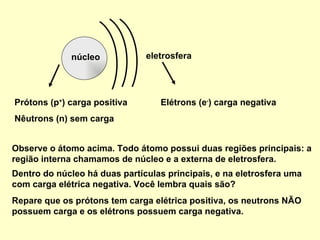
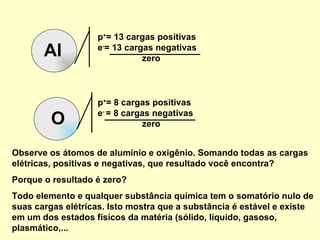
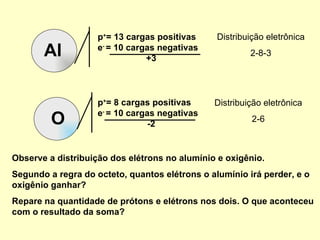
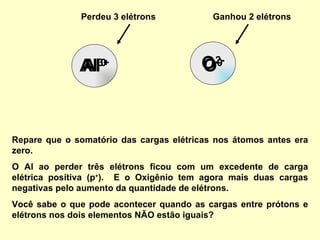
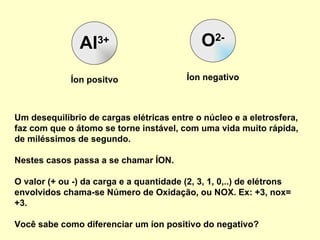
O documento explica conceitos químicos básicos como íons, cátions, ânions e número de oxidação através de exemplos como o óxido de alumínio. Também mostra como escrever fórmulas químicas de substâncias simples e compostas usando os números de oxidação para garantir a neutralidade de cargas.