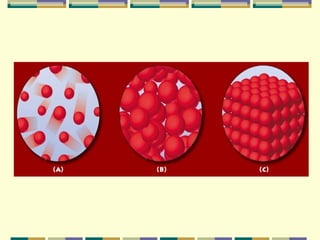
1) O documento discute os estados físicos da matéria e as propriedades dos gases.
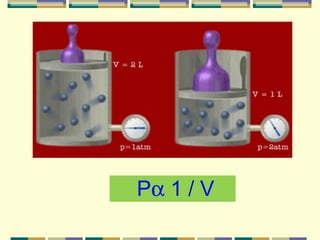
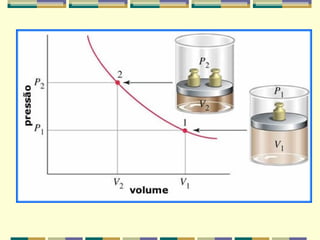
2) Os fatores que influenciam o volume dos gases são a pressão e a temperatura. A pressão é inversamente proporcional ao volume e a temperatura é diretamente proporcional.
3) A teoria cinética dos gases perfeitos descreve o movimento aleatório das moléculas em um gás.