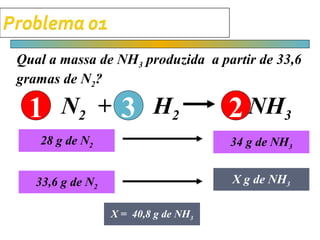
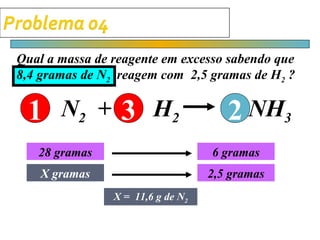
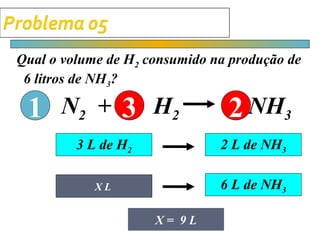
O documento apresenta cálculos de estequiometria envolvendo reações químicas, como a reação de síntese de amônia a partir de nitrogênio e hidrogênio. São mostrados cálculos para determinar massas, volumes e rendimentos em diferentes situações problema.