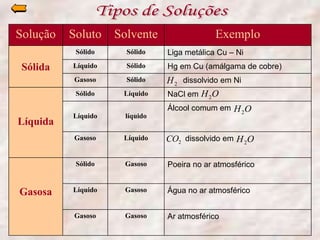
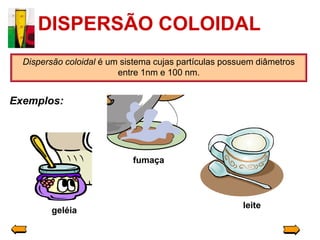
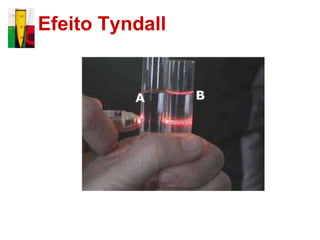
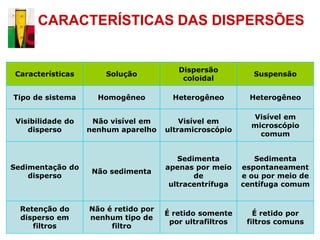
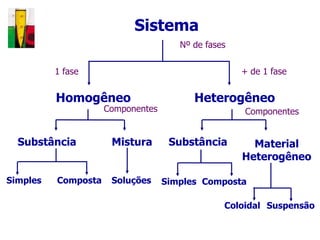
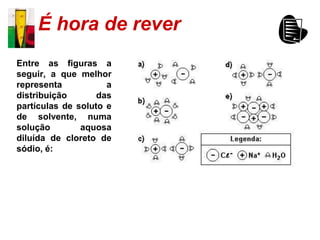
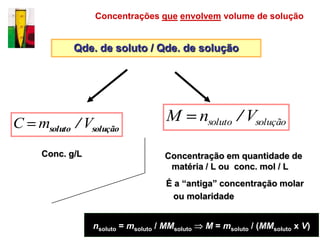
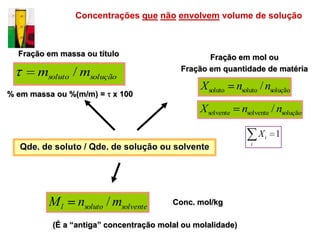
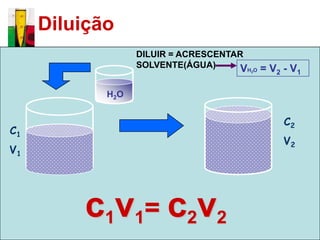
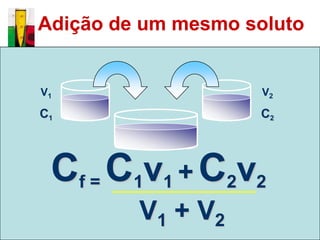
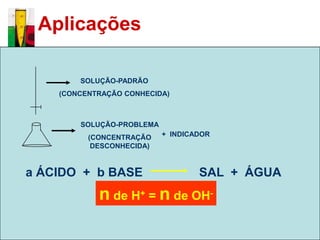
O documento descreve três tipos principais de dispersões químicas: soluções, dispersões coloidais e suspensões. Soluções têm partículas menores que 1 nm, dispersões coloidais têm de 1-100 nm, e suspensões têm maiores que 100 nm. Cada tipo tem características diferentes de visibilidade, sedimentação e retenção em filtros.