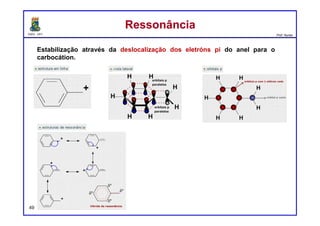
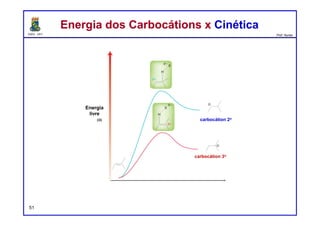
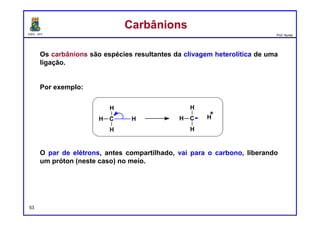
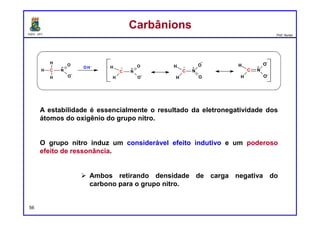
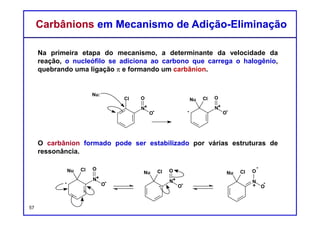
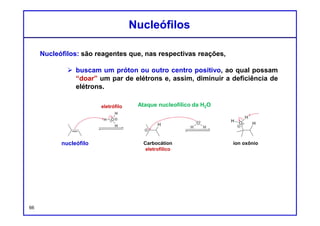
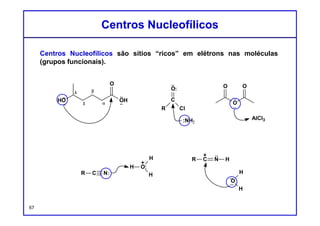
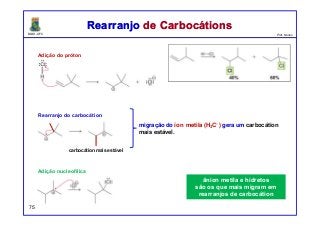
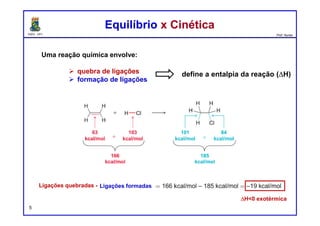
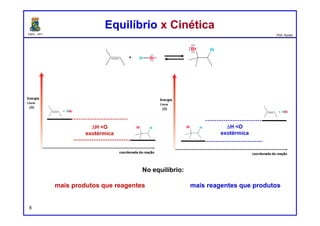
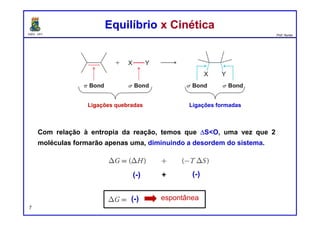
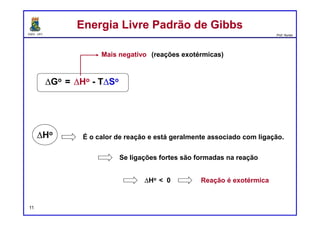
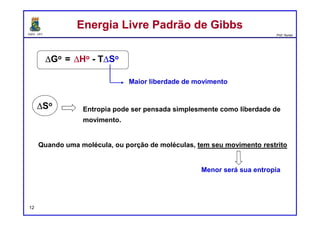
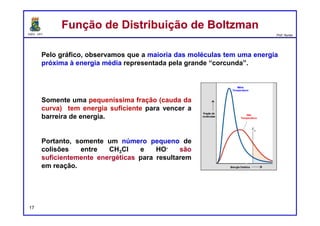
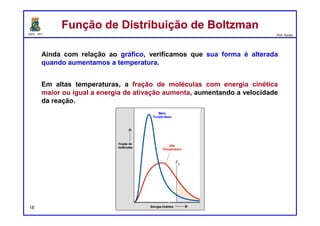
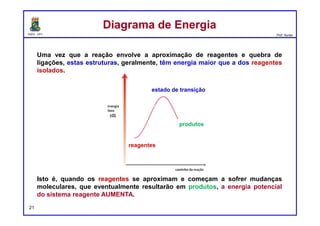
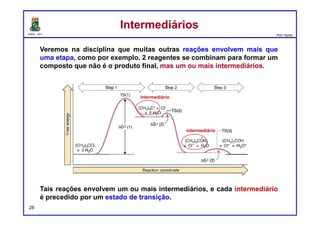
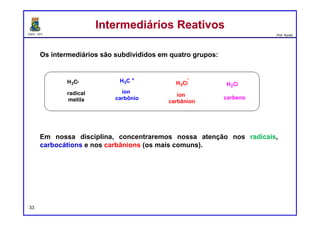
O documento discute os conceitos de entalpia, entropia e energia livre de Gibbs no contexto de reações químicas. Explica que a entalpia mede a troca de energia em uma reação, enquanto a entropia está relacionada à probabilidade e desordem do sistema. A energia livre de Gibbs leva em conta ambos os fatores para determinar a espontaneidade de uma reação.
















![DQOI - UFC Prof. Nunes
36
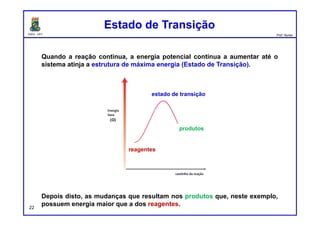
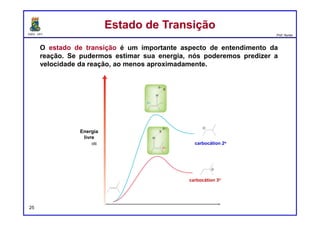
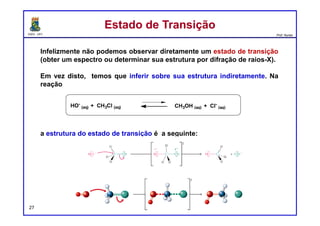
Por que é que alguns processos espontâneos são rápidos, como
explosões, enquanto outros são lentos, como diamantes se
transformando em grafite?
O estudo das velocidades de reação é chamado de cinética.
A velocidade de qualquer reação é descrita por uma equação de
velocidade, que tem a seguinte forma geral:
V= k [A] V= k [A] [B] V= k [A]2 [B]
Primeira Ordem Segunda Ordem Terceira Ordem
Cinética – Equações de VelocidadeCinética – Equações de Velocidade
V = k [A]x [B]y](https://image.slidesharecdn.com/unidade00-130401122609-phpapp02/85/Introducao-as-Reacoes-Organicas-35-320.jpg)
![DQOI - UFC Prof. Nunes
37
V= k [A] V= k [A] [B] V= k [A]2 [B]
Primeira Ordem Segunda Ordem Terceira Ordem
A constante de velocidade (k) é um valor que é específico para cada
reação e depende de 3 fatores.
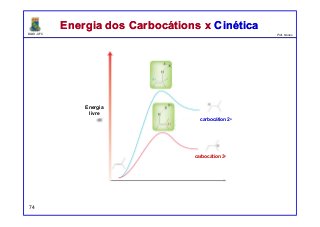
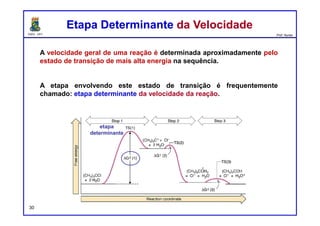
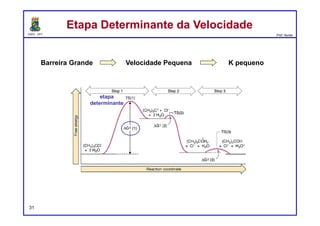
1) Energia de Ativação. A barreira de energia (a corcunda) entre os
reagentes e os produtos é chamada de energia de ativação, ou Ea. Esta
barreira de energia representa a quantidade mínima de energia necessária
para uma reação ocorrer entre dois reagentes que colidem.
Cinética – Equações de VelocidadeCinética – Equações de Velocidade
Coordenada da reação
Reagentes
Produtos](https://image.slidesharecdn.com/unidade00-130401122609-phpapp02/85/Introducao-as-Reacoes-Organicas-36-320.jpg)