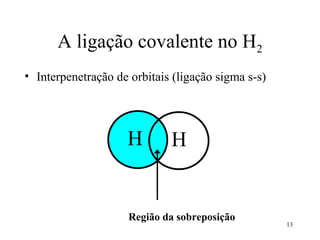
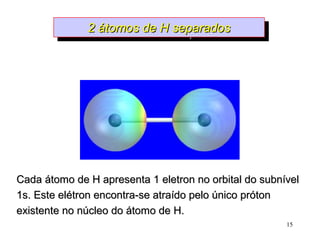
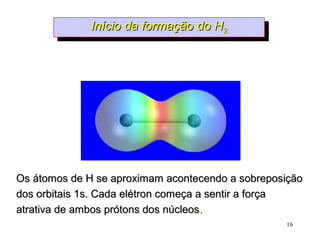
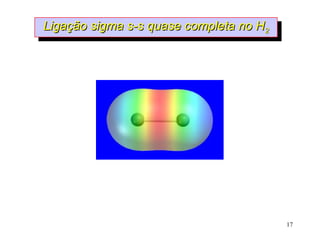
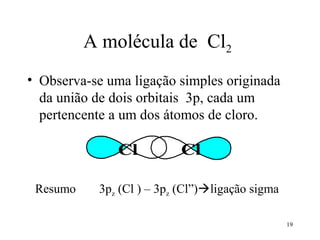
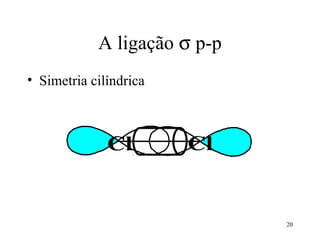
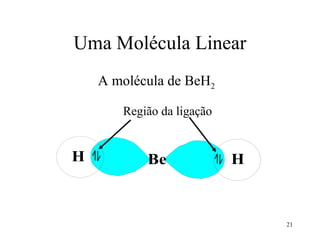
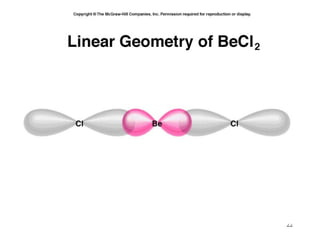
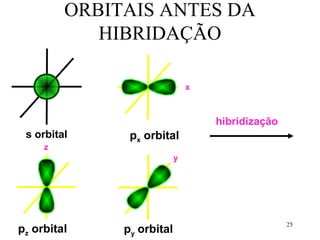
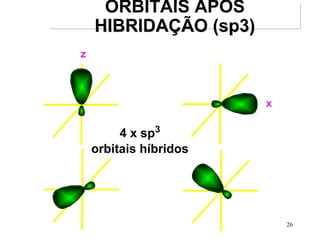
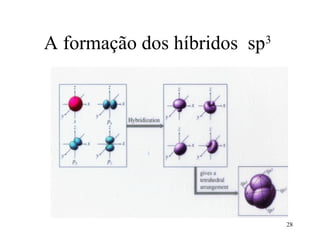
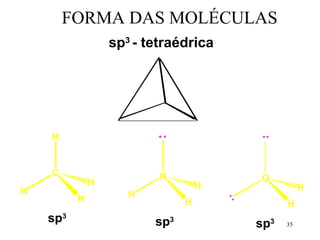
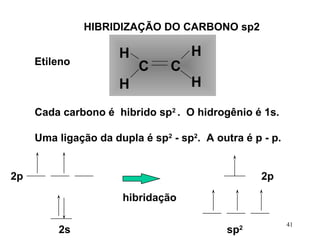
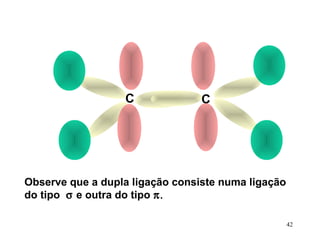
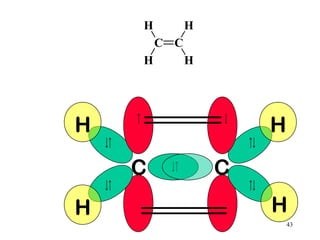
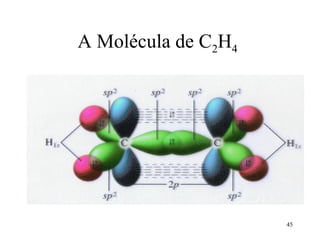
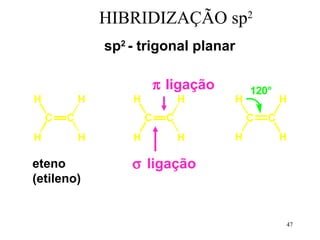
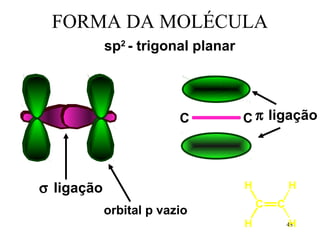
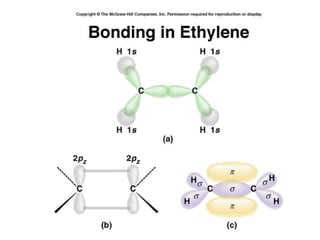
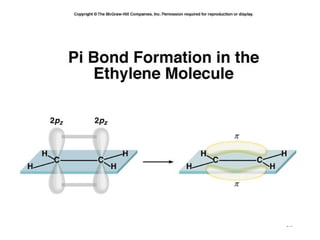
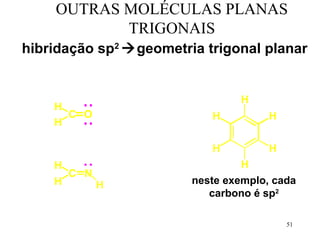
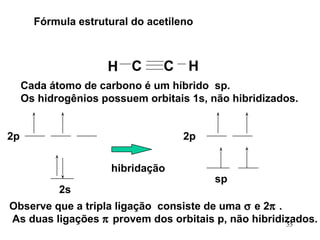
O documento discute geometria molecular e tipos de hibridização de orbitais. Explica como a hibridização sp3, sp2 e sp resultam em geometrias tetraédrica, planar triangular e linear, respectivamente. Ilustra essas geometrias em moléculas como metano (CH4), eteno (C2H4) e acetileno (C2H2).



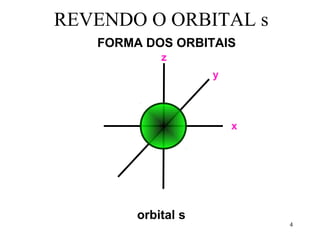
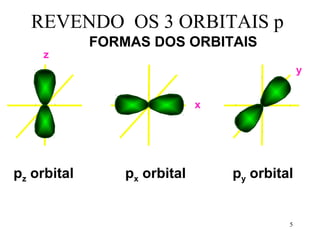










![Exemplo de hibridação sp3 CH4
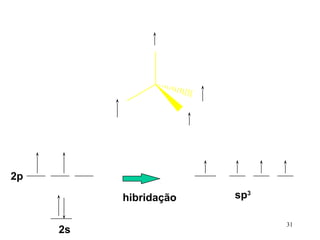
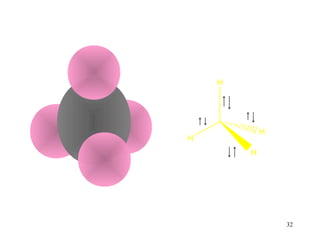
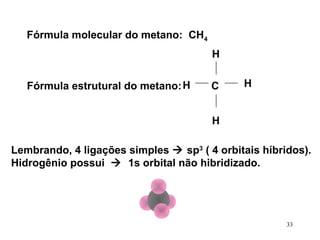
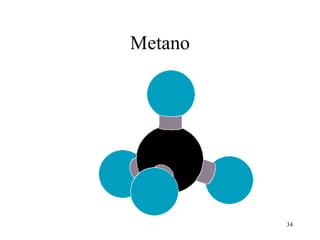
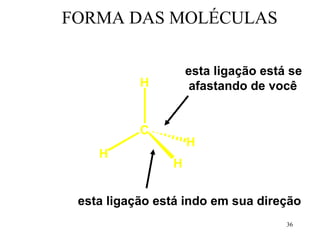
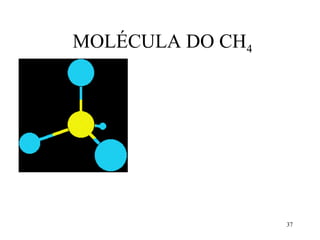
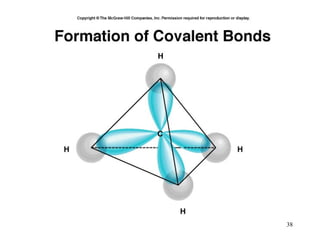
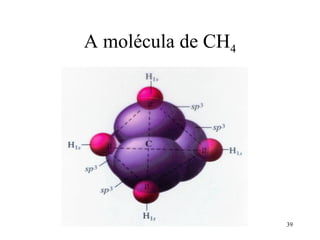
• No CH4, os 4 orbitais híbridos sp3 do C se
ligam com os orbitais s de 4 átomos de H,
formando 4 ligações sigma C-H
[sp3 (C) – 1s (H) ] x 4 ligação σ
29](https://image.slidesharecdn.com/hibridizao-130227161719-phpapp01/85/Hibridizacao-29-320.jpg)






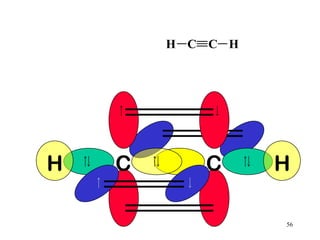
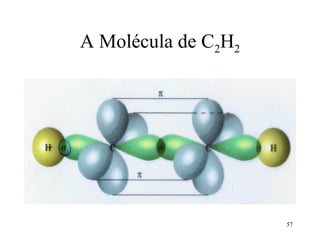
![Tipos de ligações no C2H2
• No acetileno existem 3 tipos de ligações:
ligações sigma s-sp; ligação sigma sp-sp;
ligações pi
[sp (C 1 ) – 1s (H) ] x 2 tipo σ
[sp (C 1 ) – sp (C 2 ) ] tipo σ
[2py (C 1 ) – 2py (C 2 ) ] tipo π
[2pz (C 1 ) – 2pz (C 2 ) ] tipo π
58](https://image.slidesharecdn.com/hibridizao-130227161719-phpapp01/85/Hibridizacao-58-320.jpg)
