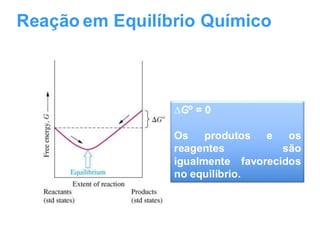
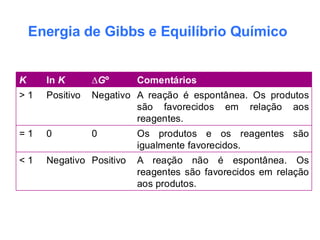
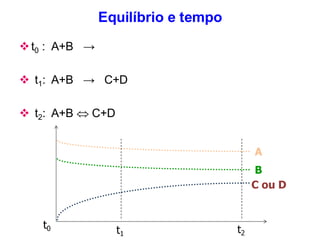
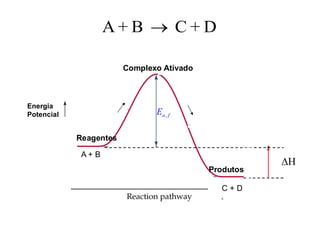
O documento aborda os fundamentos do equilíbrio químico, destacando que reações tendem a alcançar um estado de equilíbrio onde as velocidades das reações direta e inversa se igualam. Também explora o conceito de constante de equilíbrio e a relação entre as concentrações de reagentes e produtos, além de descrever como fatores como a pressão e a temperatura afetam o sistema. Exemplos práticos são fornecidos para ilustrar a determinação da constante de equilíbrio em diferentes reações químicas.









![A CONSTANTE DE EQUILÍBRIO
A , B
Inicialmente,
Velocidade da Reação: [A][B]
f f
r k
=
Velocidade da
reação direta
Inicialmente C e D não estão presentes, ou seja, não há
reação inversa. Há apenas a reação direta:
A + B C + D
→](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-12-320.jpg)
![A CONSTANTE DE EQUILÍBRIO
A , B ,
C , D
Após um certo tempo, a concetração
de C e D cresce e a reação inversa
começa acontecer também:
C + D A + B
→
Velocidade da Reação: [C][D]
b b
r k
=
Velocidade da
Reação Inversa
Conforme a reação prossegue, as concentrações
de A e B caem, ao passo que as de C e D
aumentam. As velocidades das reações direta e
inversa seguem o seguinte comportamento:](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-13-320.jpg)
![A CONSTANTE DE EQUILÍBRIO
[A][B]
[C][D]
f f
b b
r k
r k
=
=
f
r
b
r
Quando as velocidades se tornam iguais, as concentrações de A, B, C e
D não mais mudam no tempo. Atingiu-se o equlíbrio químico. No
entanto, lembre-se que ao nível molecular tanto a reação direta quanto a
inversa continuam ocorrendo, pois o equilíbrio é dinâmico, só que
ocorrem continuamente na mesma velocidade.](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-14-320.jpg)
![A CONSTANTE DE EQUILÍBRIO
[A][B] [C][D]
[C][D]
a constant
[A][B]
f b
f b
f
b
r r
k k
k
K
k
=
=
= = =
Concentrações de Produtos
Concentrações de Reagentes
C D
K
A B
c d
a b
=
Para o exemplo
realizado na lousa e
para uma formulação
mais completa, levando-
se em conta a lei de
ação das massas:
Se K é conhecida, pode-se prever as
concentrações de reagentes ou produtos.](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-15-320.jpg)
![A estequiometria e o equilíbrio
❖ Consideremos a seguinte reação reversível:
aA + bB cC + dD
Onde a, b, c e d são os coeficientes estequiométricos das
espécies A, B, C e D. A constante de equilíbrio da reação a uma
determinada temperatura é:
b
a
d
c
B
A
D
C
K
]
[
]
[
]
[
]
[
=
←
→](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-16-320.jpg)
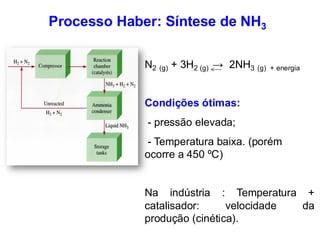
![N2(g) + 3H2(g) 2 NH3(g)
Ex. 1: Determine a constante de equilíbrio para a reação abaixo:
N2(g) + 3H2(g) 2NH3(g)
Sabendo que:
H2 = 0,324 mol.L-1; N2 = 0,305 mol.L-1; NH3 = 0,796 mol.L-1
[NH3]2
[H2]3 .[N2]
Kc =
[0,796]2
[0,324]3 .[0,305]
Kc = Kc = 61,60](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-17-320.jpg)
![Ex. 2: Suponha que em uma mistura em equilíbrio entre H2, Cl2, para formar HCl as
concentrações de H2 e Cl2 sejam 1.10-11 mol.L-1 e 2.10-10, respectivamente.
Determine a concentração molar de HCl sabendo que Kc = 4,8.1018.
H2(g) + Cl2(g) 2HCl(g)
[HCl]2
[H2].[Cl2]
Kc =
[HCl] = [H2].[Cl2]
Kc [HCl] = 0,089 mol.L-1](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-18-320.jpg)
![Determinação de K
2 NOCl(g) 2 NO(g) + Cl2(g)
Coloque 2,00 mol de NOCl em um frasco de 1,00 L.
No equilíbrio você encontra 0,66 mol/L de NO.
Calcule K.
Solução
Construa uma tabela de concentrações
[NOCl] [NO] [Cl2]
Inicial 2,00 0 0
Variação
Equilíbrio 0,66](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-19-320.jpg)
![Determinação de K
2 NOCl(g) 2 NO(g) + Cl2(g)
Coloque 2,00 mol de NOCl em um frasco de
1,00 L. No equilíbrio você encontra 0,66
mol/L de NO. Calcule K.
Solução
Construa uma tabela de concentrações
[NOCl] [NO] [Cl2]
Inicial 2,00 0 0
Variação -0,66 +0,66 +0,33
Equilíbrio 1,34 0,66 0,33](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-20-320.jpg)
![Determinação de K
2 NOCl(g) 2 NO(g) + Cl2(g)
[NOCl] [NO] [Cl2]
Inicial 2,00 0 0
Variação -0,66 +0,66 +0,33
Equilíbrio 1,34 0,66 0,33
K =
[NO]2[Cl2]
[NOCl]2
( ) ( )
( )
080
,
0
34
,
1
33
,
0
66
,
0
K 2
2
=
=](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-21-320.jpg)
![04) Foram colocados em um recipiente fechado, de capacidade 2,0 L, 6,5 mol
de CO e 5 mol de NO2. À 200°C o equilíbrio foi atingido e verificou-se que
haviam sido formados 3,5 mol de CO2.
Podemos dizer que o valor de Kc para o equilíbrio dessa reação é:
a) 4,23.
b) 3,84.
c) 2,72.
d) 1,96.
e) 3,72.
=
KC
[ CO2 ] [ NO ]
[ CO ] [ NO2 ]
x
x
1,75
1,50 0,75
CO + NO2 CO2 + NO
início
reage / produz
equilíbrio 3,5 3,5
3,5 3,5
3,0 1,5
6,5 5,0
3,5 3,5
0,0 0,0
[ NO ] =
3,5
2,0
= 1,75 M
[ CO ] =
3,0
2,0
[ NO2 ] =
1,5
2,0
= 0,75 M
[ CO2 ] =
3,5
2,0
= 1,75 M
= 1,50 M
1,75
=
KC x
x
3,0625
1,125
=
KC KC = 2,72](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-22-320.jpg)
![Determinação de K
Exemplos
Escreva as expressões de constante de equilíbrio
para as seguintes reações:
Equações Químicas
balanceadas c
K
2
3
3
2 2
[NH ]
[N ][H ]
c
K =
2 2
2
[H ][I ]
[HI]
c
K =
2
3
2
2 2
[SO ]
[SO ] [O ]
c
K =](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-23-320.jpg)
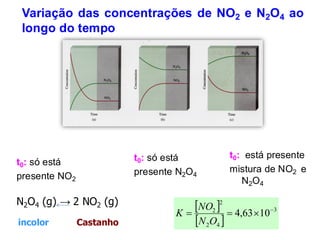
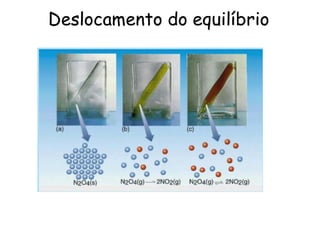
![Kc : constante de equilíbrio
Consideremos o seguinte sistema em equilíbrio.
N2O4 (g) 2 NO2 (g)
A constante de equilíbrio é dada por:
Kc –constante de equilíbrio
Concentrações das espécies reagentes são expressas
em mol/L.
]
O
N
[
]
NO
[
4
2
2
2
=
c
K](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-25-320.jpg)



![Considere a reação abaixo:
N2O4 (g) 2NO2 (g)
Observe a relação entre Kc e Kp:
Kc = [NO2]2 / [N2O4] Kp = (PNO2)2 / PN2O4
Aplicando a equação dos gases para NO2 e para N2O4:
PNO2 = n. R.T = [NO2] . R. T
V
PN2O4 = n. R. T = [N2O4] . R. T
V](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-29-320.jpg)
![Kp = (PNO2)2 / PN2O4
PNO2 = n. R.T = [NO2] . R. T
V
PN2O4 = n. R. T = [N2O4] . R. T
V
Kp = ([NO2] . R. T)2
([N2O4] . R. T)1
Kp = [NO2]2 . (R . T) 2-1
[N2O4]
Kc
Kp = Kc (R . T)1 → Kp = Kc . (R . T ) Δn
Onde: R = 0,082 atm.L.K-1.mol-1 e T em K 30](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-30-320.jpg)

![Gases: A constante de Equilíbrio,
KP
• Misturas de gases são soluções, da mesma forma
que os líquidos.
• Use KP, baseado nas pressões parciais dos gases.
Equações Químicas
balanceadas c
K
2
3
3
2 2
[NH ]
[N ][H ]
c
K =
2 2
2
[H ][I ]
[HI]
c
K =
2
3
2
2 2
[SO ]
[SO ] [O ]
c
K =
p
K
3
2 2
2
NH
3
N H
p
p
K
p p
=
2 2
H I
2
HI
p
p p
K
p
=
3
2 2
2
SO
2
SO O
p
p
K
p p
=](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-33-320.jpg)
![Líquidos e Sólidos Puros
• As expressões das constantes de equilíbrio não têm
termos de concentração para fases líquidas ou
sólidas de um determinado componente (isto é,
sólidos ou líquidos puros).
C(s) + H2O(g) CO(g) + H2(g)
Kc =
[H2O]
[CO][H2]
e Kp =
PH2O
PCOPH2](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-34-320.jpg)
![Escrevendo e Manipulando
Expressões de K
Sólidos NUNCA
aparecem em
expressões de
equilíbrio.
S(s) + O2(g) SO2(g)
K =
[SO2]
[O2]](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-35-320.jpg)





![O Significado de K
1.Podemos dizer se a reação é reagente-
ou produto-favorecida.
Para N2(g) + 3 H2(g) 2 NH3(g)
Kc =
[NH3]2
[N2][H2]3
= 3.5 x 108
Conc. de produtos é muito maior que a de reagentes no
equilíbrio.
A reação é fortemente produto-favorecida.](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-41-320.jpg)
![Para AgCl(s) Ag+(aq) + Cl-(aq)
Kc = [Ag+] [Cl-] = 1,8 x 10-5
Conc. de produtos é muito menor que a de
reagentes no equilíbrio.
A reação é fortemente reagente-favorecida.
Significado de K](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-42-320.jpg)


![Queima de Calcário
CaCO3(s) CaO(s) + CO2(g)
Kc = [CO2] KP = PCO2
(RT)](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-47-320.jpg)
![Equilíbrio heterogêneo
CaCO3 (s) → CaO(s) + CO2(g)
Kc = [CO2]
KP = PCO2
A pressão de CO2 no equilíbrio é a
mesma independentemente das
quantidades da fase sólida (neste
caso, de CaCO3 e CO2) à mesma
temperatura.
Sistemas fechados
←](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-48-320.jpg)



![Princípio de Le Châtelier
Quando uma perturbação exterior é aplicada a um sistema em equilíbrio, o sistema
tende a se ajustar para alcançar um novo equilíbrio.
* Influência da Adição e Remoção de Reagentes no Equilíbrio Químico:
H2(g) + Cl2(g) 2HCl(g)
[HCl]2
[H2].[Cl2]
Kc =
O que acontece com o equilíbrio da reação se:
- Adicionar o mais HCl: Desloca o equilíbrio para reagente;
- Remover H2: Desloca o equilíbrio para reagente;
- Remover HCl: Desloca o equilíbrio para o produto;
- Adicionar o mais Cl2: Desloca o equilíbrio para o produto;](https://image.slidesharecdn.com/aula4equilibrioquimico-250130202054-5b3dbd46/85/Apresentacao-aula_4_equilibrio_quimico-pdf-52-320.jpg)