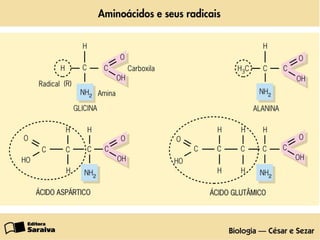
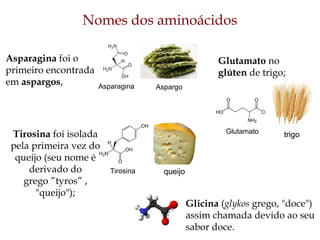
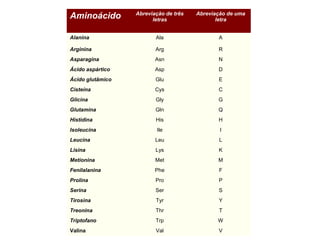
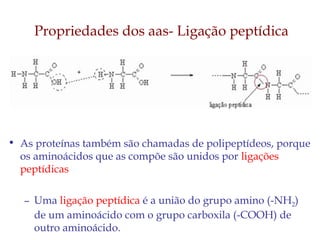
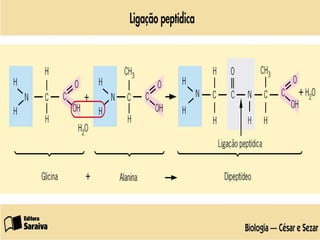
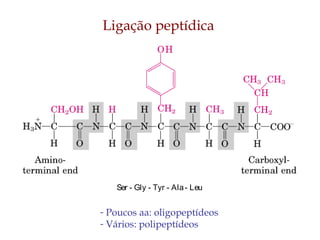
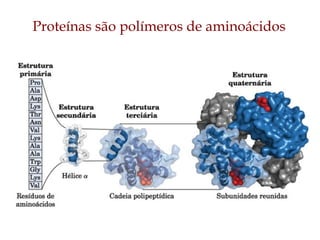
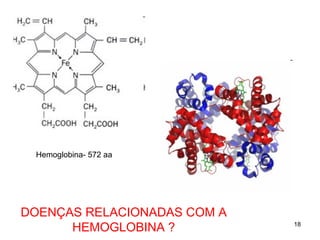
O documento discute as estruturas e funções das proteínas. Ele explica que as proteínas são macromoléculas constituídas de aminoácidos que desempenham funções estruturais e metabólicas importantes no corpo, como a formação de tecidos, enzimas, hormônios, defesa e transporte. O documento também descreve a composição dos aminoácidos, as ligações peptídicas que os unem, e classificações de proteínas.