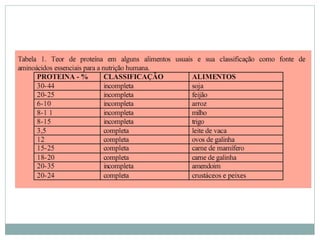
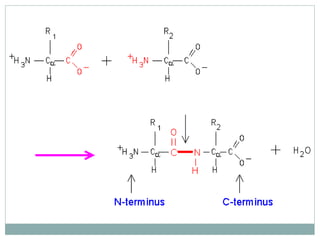
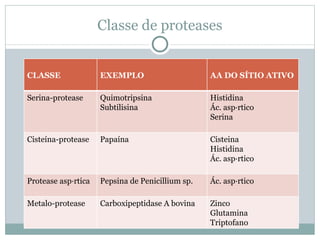
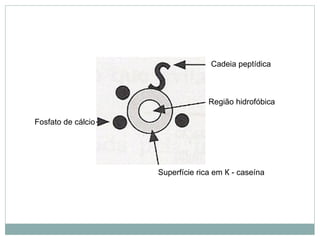
O documento discute proteínas em alimentos, incluindo suas funções, tipos, e aplicações industriais. Ele descreve as principais proteínas encontradas em carnes, leite e ovos, assim como proteínas vegetais e microbianas. Também explica o papel de enzimas proteolíticas na clarificação de cerveja, amaciamento de carne e coagulação do leite.