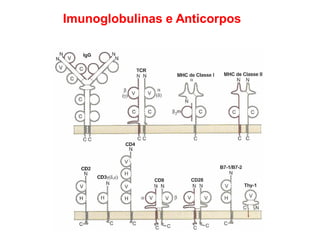
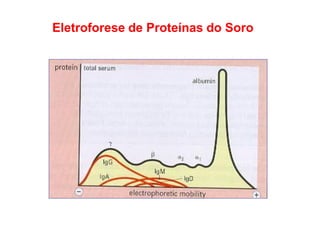
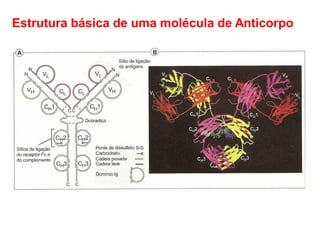
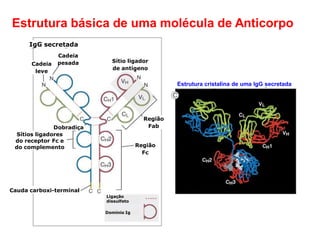
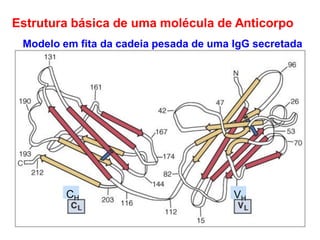
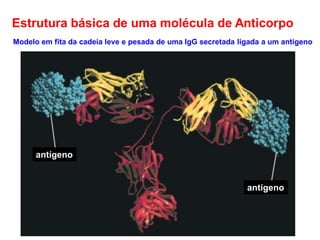
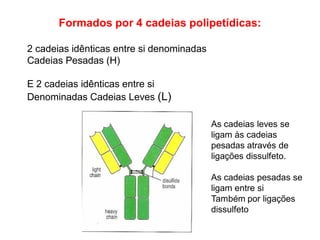
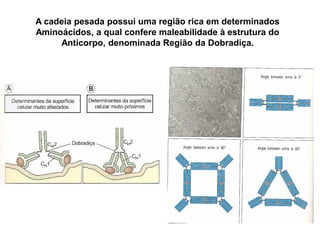
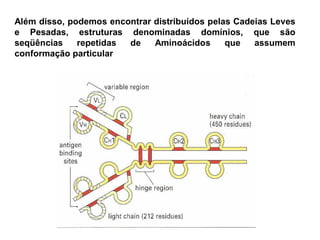
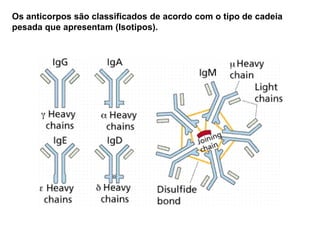
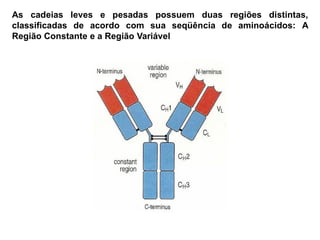
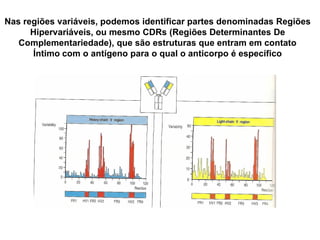
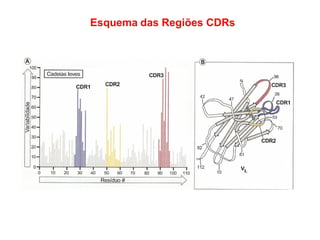
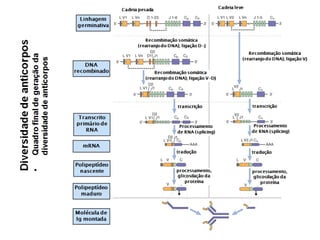
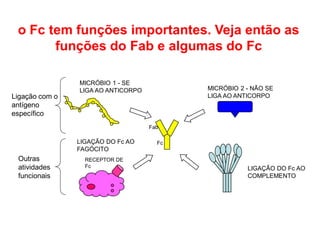
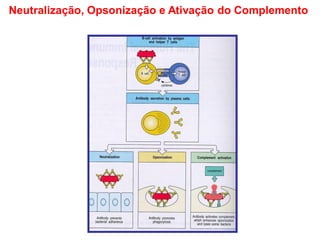
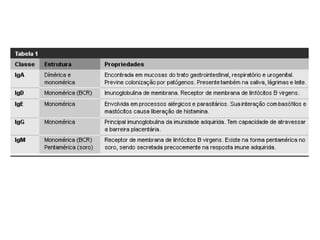
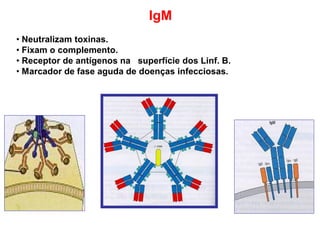
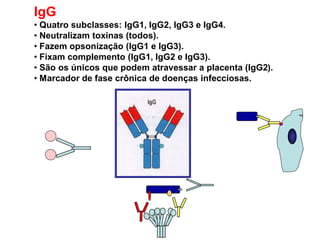
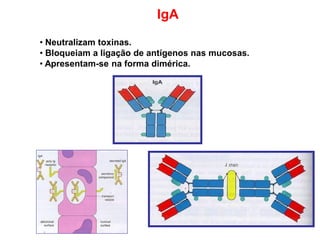
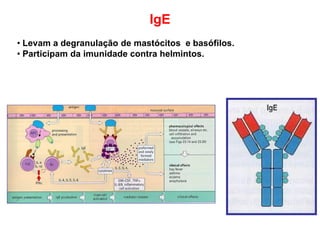
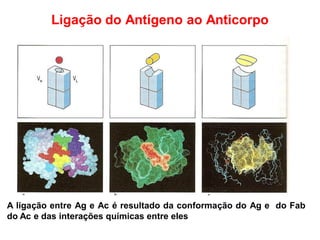
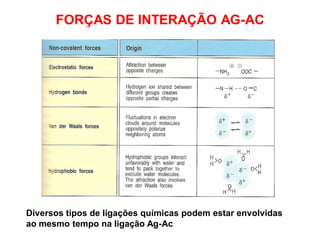
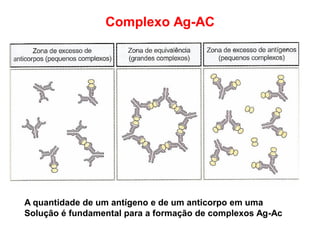
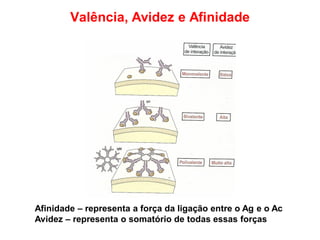
O documento descreve a estrutura e função dos anticorpos e imunoglobulinas. Apresenta suas características gerais, como serem proteínas globulares secretadas por linfócitos B que conferem especificidade à resposta imune. Detalha também a estrutura básica dos anticorpos, compostos por cadeias leves e pesadas, e suas diferentes classes e funções.