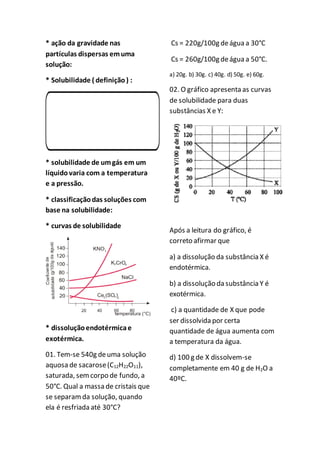
O documento discute conceitos sobre soluções e propriedades coligativas, incluindo: 1) tipos de dispersões como soluções verdadeiras, soluções coloidais e suspensões; 2) concentração de soluções; 3) propriedades coligativas de soluções. O documento também apresenta questões sobre esses tópicos.