O documento descreve os principais tópicos da cinética química e do equilíbrio químico, incluindo: 1) a velocidade das reações químicas e como ela é calculada; 2) os fatores que influenciam a velocidade das reações, como a temperatura, estado físico dos reagentes, e concentração; 3) as condições necessárias para que as reações ocorram, como afinidade química e contato entre moléculas. O documento também fornece detalhes sobre equilíbrio qu


















![Capítulo01. CinéticaQuímica12
Físico-químicaII
PV2D-06-QUI-41
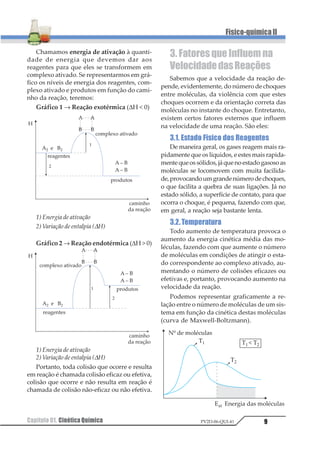
3.8. Concentração dos Reagentes
Lembrando que uma reação se processa
por meio de choques moleculares, conclui-se
facilmente que um aumento de concentração
dos reagentes determina um aumento da ve-
locidade da reação pois, aumentando-se a con-
centração, aumenta-se o número de molécu-
las reagentes e, conseqüentemente, aumenta,
também, o número de choques moleculares.
Vamos analisar a reação entre A e B em 3
situações diferentes, todas ocorrendo num
recipiente de mesmo volume:
A + B → AB
1ª situação
1 molécula de A e 1 molécula de B
A
B
se houver uma molécula de A e 1 molécula
de B, haverá certa probabilidade de choque e,
conseqüentemente, certa velocidade de reação.
2ª situação
Dobremos a concentração de um dos
reagentes:
A
B
A
ou
A
B
B
Ao se dobrar a concentração de A (ou de
B), a probabilidade de a molécula de um dos
reagentes chocar-se com a molécula do outro
reagente dobra, e , conseqüentemente, a velo-
cidade da reação aumenta duas vezes.
3ª situação
Dobremosaconcentraçãodosdoisreagentes.
A B
B
A
Se duplicarmos simultaneamente o núme-
ro de moléculas de A e B, a probabilidade de
choque será quatro vezes maior e a velocida-
de quadruplicará.
Concluindo, podemos dizer que o aumen-
to da concentração dos reagentes (número de
moléculas por unidade de volume) aumenta
o número de choques, fazendo aumentar a
velocidade das reações.
Vários cientistas tentaram estabelecer
uma relação matemática entre a velocidade
da reação e a concentração, entretanto, foram
Guldberg e Waage, em 1867, que enunciaram
a lei que relaciona essas duas grandezas, a
qual recebeu o nome da Lei da Ação das Mas-
sas, cujo enunciado é o seguinte:
“Avelocidade de uma reação é diretamen-
te proporcional ao produto das concentra-
ções molares dos reagentes, elevadas a po-
tências determinadas experimentalmente”.
Para reações que se realizam em uma só
etapa (reações elementares), as potências que
elevam as concentrações coincidem com os
coeficientes da reação.
Assim, para a reação:
aA + bB → cC + dD
a lei da velocidade é expressa por:
v = K · [A]a · [B]b
em que:
v → velocidade da reação
[A] → concentração molar do reagente A.
[B] → concentração molar do reagente B.
a → ordem do reagente A.
b → ordem do reagente B.
a + b → ordem global da reação
K → concentração cinética ou constante
de velocidade da reação.
Exemplos
NO2 + CO → NO + CO2
v = K · [NO] · [CO] Lei de Velocidade
2 NO + H2 → N2O + H2O
v = K · [NO]2 · [H2] Lei de Velocidade](https://image.slidesharecdn.com/radiococshare-160426214118/85/Radio-coc-share-20-320.jpg)
![Capítulo01. CinéticaQuímica 13
Físico-químicaII
PV2D-06-QUI-41
Para as reações não-elementares (ocor-
rem em várias etapas), a velocidade da rea-
ção é determinada pela velocidade de etapa
mais lenta do mecanismo.
Por exemplo:
4 HBr(g) + O2(g) → 2 H2O(g) + 2 Br2(g)
(Equação global)
cujo mecanismo é:
HBr + O2 → HBrO2 (Etapa lenta)
HBrO2 +HBr→ 2 HBrO (Etapa rápida)
2HBrO+2HBr→2H2O+2Br2 (Etaparápida)
A lei de velocidade é determinada pela eta-
pa lenta e não pela equação global.
v = K · [HBr] · [O2]
Em decorrência das considerações feitas
acima, podemos definir dois conceitos muito
importantes na cinética química:
Ordem: corresponde aos expoentes dos
termos de concentração na lei de velocidade.
Exemplo: 2 NO + H2 → N2O + H2O
v = K · [NO]2 · [H2]
Em relação ao NO, a reação é de 2ª ordem
ou ordem 2.
Em relação ao H2, a reação é de 1ª ordem
ou ordem 1.
Em relação à reação, sem especificar
reagente, é 3ª ordem ou ordem 3 (soma de to-
dos os expoentes na lei de velocidade)
Molecularidade: é o número de molécu-
las que se chocam para que ocorra uma rea-
ção elementar ou uma etapa de uma reação
não-elementar. Assim, as reações podem ser
moleculares, bimoleculares e trimoleculares.
Exemplo
1 1 1 123 4 2 3 4 3+ → +
⇒
234567896
3](https://image.slidesharecdn.com/radiococshare-160426214118/85/Radio-coc-share-21-320.jpg)




![Capítulo 02. Equilíbrio Químico 15
Físico-químicaII
PV2D-06-QUI-41
Exemplo
Consideramosareaçãox →y+z,emque,no
início, encotramos 2,00 mols de x e no equilíbrio
são encontrados 0,80 mols de x sem reagir. Con-
cluímos,então,quereagiu2,00–0,80=1,20mols
de x. O grau de equilíbrio fica:
α =
1234
3244
α = 0,60 α = 60%
Concluindo, podemos dizer que quanto
maior o valor de α no equilíbrio, encontra-
mos menor sobra de reagentes em maior
quantidade de produtos. Quanto menor o
valor de α no equilíbrio, encontramos muita
sobra de reagentes e pouco produto.
4. ConstantedeEquilíbrioem
Termos de Concentrações
Molares (Kc)
Dada uma reação reversível qualquer:
aA + bB
1
2
⎯ →⎯← ⎯⎯ cC + dD
Aplicando-se a lei da ação das massas de
Guldberg-Waage, temos:
• para a reação direta:
v1 = K1 · [A]a · [B]b
• para a reação inversa:
v2 = K2 · [C]c · [D]d
No equilíbrio: v1 = v2
K1 ·[A]a ·[B]b =K2 ·[C]c ·[D]d
1
1
2 3
4 56
1 2
3 4
5
6
=
⋅
⋅
7 6 7 6
7 6 7
A relação
1
1
1
2
é constante e denomina-se
constante de equilíbrio em termos de concen-
tração molar (Kc):
1
2 3
4 56
1
1 2
3 4
=
⋅
⋅
7 6 7 6
7 6 7
A constante de equilíbrio Kc é, portanto, a
razão das concentrações dos produtos da re-
ação e das concentrações dos reagentes da
reação, todas elevadas a expoentes que cor-
respondem aos coeficientes da reação.
Observações
a) A constante de equilíbrio Kc varia com a
temperatura.
b) Quanto maior o valor de Kc , maior o ren-
dimento da reação, já que no numerador
temos os produtos e no denominador os
reagentes. Portanto, comparando valores
de Kc em duas temperaturas diferentes,
podemos saber em qual destas a reação
direta apresenta maior rendimento.
c) O valor numérico de Kc depende de como
é escrita a equação química.
Por exemplo
1
2
1
2
1 1
2
1
2
1
1
2
1
1 1
1
1
1 1
3 4 34
5
34
3 4
3 4
5
34
3 4
1
1
+
=
⋅
+
=
⋅
1
1
6 7
6 7 6 7
6 7
6 7 6 7
234
1 11 11 2
≠
Por este motivo devemos escrever sempre
a equação química junto com o valor de Kc .
d) A constante de equílibrio é adimensional,
ou seja, não possui unidade.
O cálculo da constante de equilíbrio envol-
ve conceitos da termodinâmica que os alu-
nos trabalham somente nas universidades,
mas vamos procurar demonstrar tal fato.
A constante de equilíbrio, pela
termodinâmica, pode ser calculada:
11 1
2
3 4
=
°
⋅
∆](https://image.slidesharecdn.com/radiococshare-160426214118/85/Radio-coc-share-26-320.jpg)
![Capítulo 02. Equilíbrio Químico16
Físico-químicaII
PV2D-06-QUI-41
em que ∆G° é denominada de energia li-
vre padrão e ln é o logarítimo neperiano.
Colocando-se as unidades na equação, en-
contramos:
Portanto, a constante K é um número puro.
5. ConstantedeEquilíbrio
em Termos de Pressões
Parciais (Kp)
Quando os componentes do equilíbrio são
substâncias gasosas, além da constante Kc ,
podemos expressar a constante de equilíbrio
em termos de pressões parciais (Kp).
Assim para a reação:
12 34 56 781 1 1 11 2 1 2 1 2 1 2+ +1
a constante de equilíbrio pode ser:
1
2 3
4 56
1
1 2
3 4
=
⋅
⋅
⇒
7 6 7 6
7 6 7
constante de equilí-
brio em termos de concentração molar Kc .
ou
1
2 2
2 2
1
2
3
4
5
6
7
8
9=
⋅
⋅
⇒
1 2 1 2
1 2 1 2
constante de equi-
líbrio em termos de pressões parciais Kp .
Portanto, concluímos que Kp é a razão en-
tre o produto das pressões parciais dos pro-
dutos gasosos e o produto das pressões par-
ciais dos reagentes gasosos, estando todas as
pressões elevadas a expoentes iguais aos res-
pectivos coeficientes, na equação química
balencada.
Por exemplo: 1 2 12
3
4
4 4
1 1 1
2
34
3 4
5 5
5
5
1 1
1 2 1 2 1 2
1 2
3 4 3 4
+
=
⋅
1
Observação – Para equilíbrio em sistema
heterogêneo, o estado sólido não participa das
expressões Kp e Kc , o estado líquido participa
somente de Kc , e o estado gasoso participa
das duas expressões.
Exemplos
a) CaCO3 (s) S CaO(s) + CO2 (g)
Kc = [CO2]
Kp = 1121
b) 12 3 12 3
4
12 3
3
4 53
1 23 23 4
5
6
1 2 3 4 3 4 3 4+ +
=
⋅
=
+ +
+
+
6 7
7
7
7
7
7
1
7 8 7 8
7 8
c) 12 34 12 34
5
12
34
1 23 23 1
4
1 2 3 4 3 4 1 2+ +
=
+ ++
++
+
6 6
5
1
7 8
7 8
Kp não é definido, pois não encontramos
substância no estado gasoso.
6. Relação entre Kc e Kp
As constantes de equilíbrio Kc e Kp podem
ser relacionadas da seguinte forma:
Kp = Kc · (R · T)∆n
Em que:
∆n ⇒ variação da quantidade em mols
(diferença entre a quantidade em mols dos
produtos e reagentes).
Kc ⇒ constante de equilíbrio em termos
de concentração molar
T ⇒ temperatura absoluta
R ⇒ constante dos gases
7. ValoresUsuaisda
ConstanteR
R = 0,082 atm · L/mol · K
R = 62,3 mmHg · L/mol · K](https://image.slidesharecdn.com/radiococshare-160426214118/85/Radio-coc-share-27-320.jpg)




