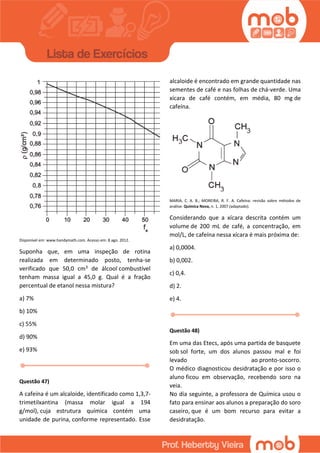
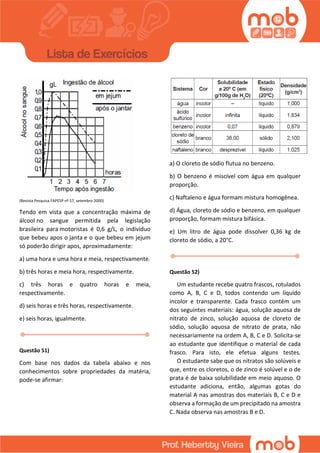
Este documento contém 18 questões sobre conceitos químicos como titulação, equilíbrio químico, concentração de soluções e reações químicas. As questões abordam tópicos como produção de etanol, combustão, propriedades dos íons e eletrólitos no corpo humano.