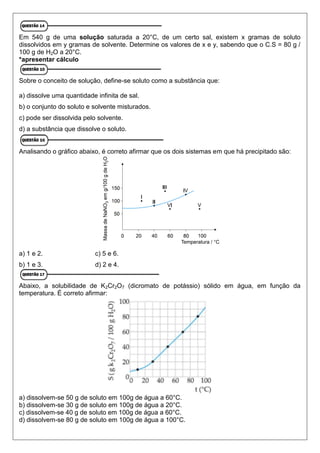
O documento fornece orientações para a realização de um trabalho de química do 2o ano do ensino médio, incluindo questões sobre naftaleno, etanol, água e óleo vegetal, reações químicas e propriedades de substâncias como cloreto de potássio e nitrato de potássio.