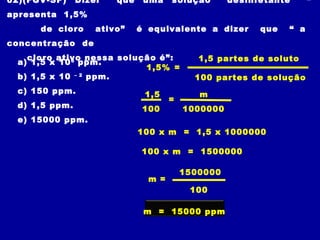
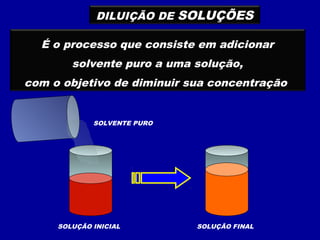
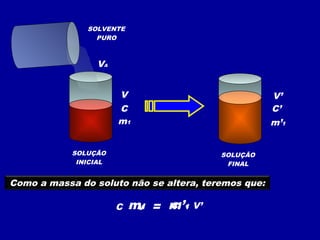
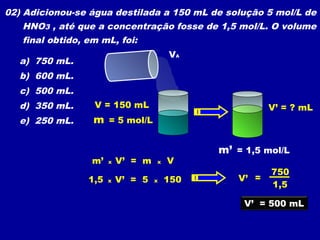
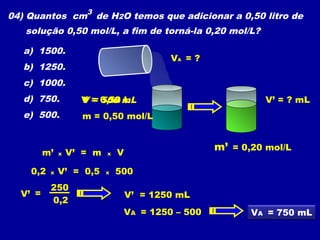
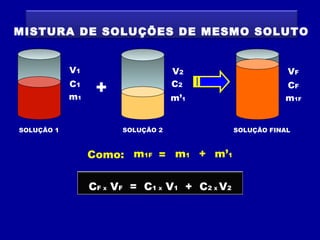
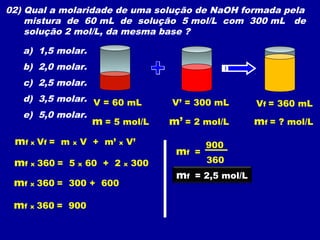
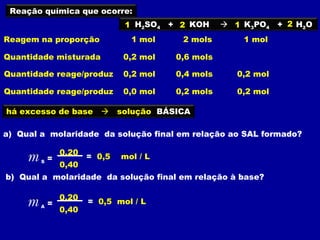
Este documento discute diferentes tipos de misturas e soluções químicas. [1] Ele explica a diferença entre misturas homogêneas e heterogêneas e introduz o conceito de dispersão, onde uma espécie química é disseminada na outra sob a forma de pequenas partículas. [2] Ele define soluções como um tipo especial de dispersão onde as partículas têm tamanho menor que 10-7 cm e introduz os termos solvente e soluto. [3] Por fim, discute conceitos como solubilidade, coeficiente de solubilidade