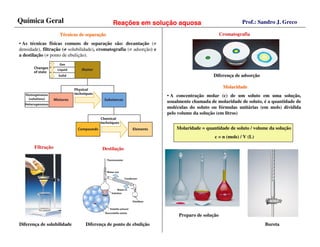
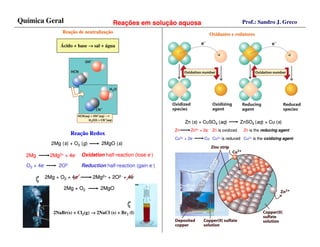
O documento discute conceitos fundamentais sobre soluções e reações químicas em solução aquosa, incluindo: (1) a definição de solução como uma mistura homogênea de solvente e soluto; (2) as classificações de misturas e técnicas de separação como filtração e destilação; e (3) os tipos de eletrólitos e reações de precipitação que ocorrem quando soluções eletrolíticas são misturadas.