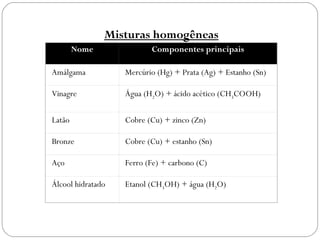
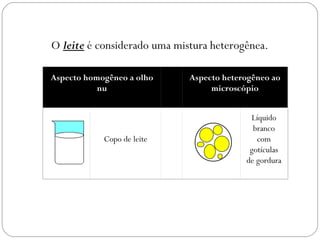
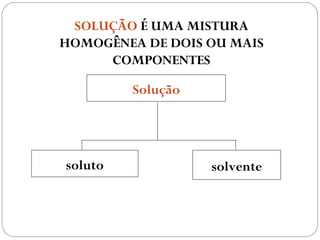
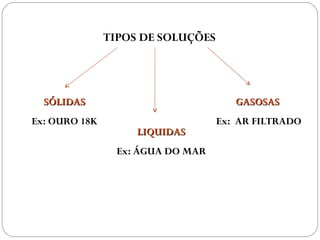
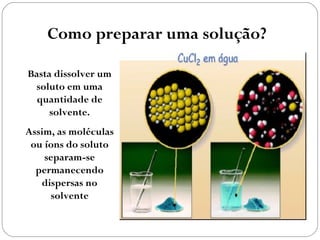
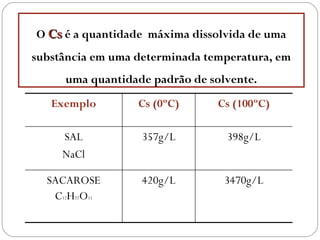
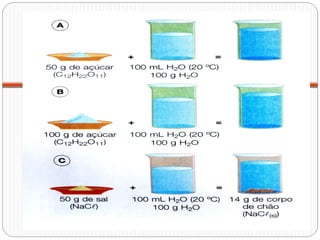
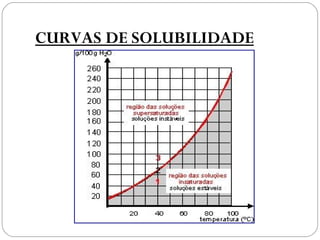
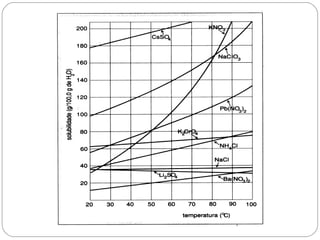
O documento discute sistemas homogêneos e heterogêneos, definindo-os como aqueles que apresentam propriedades uniformes ou não em toda sua extensão, respectivamente. Também define misturas homogêneas e heterogêneas, soluções, dispersões e tipos de soluções.