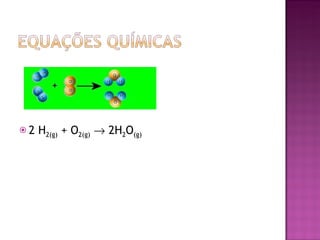
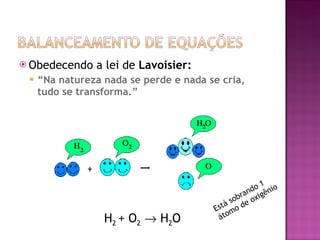
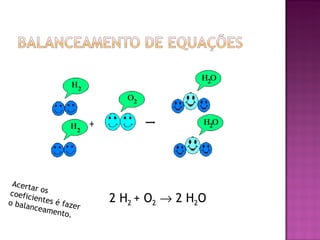
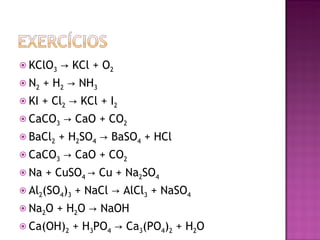
O documento descreve os tipos de equações químicas, como representar reagentes, produtos e estados físicos nas equações. Explica que o balanceamento envolve igualar os átomos de cada lado da seta e fornece regras para balancear equações de forma sistemática.