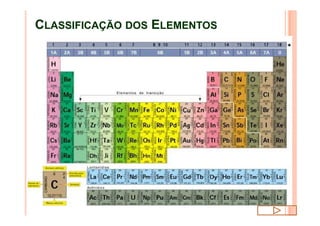
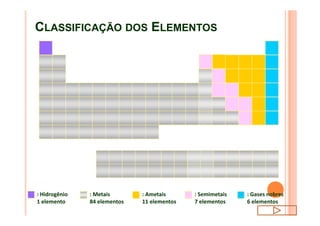
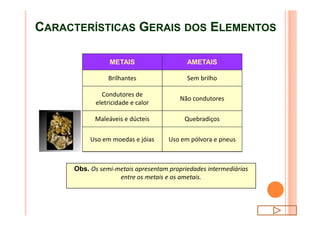
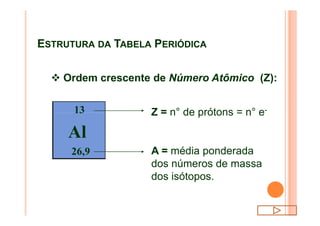
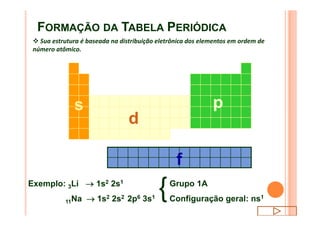
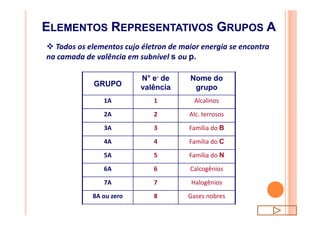
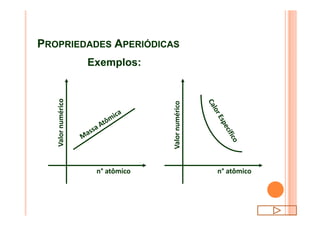
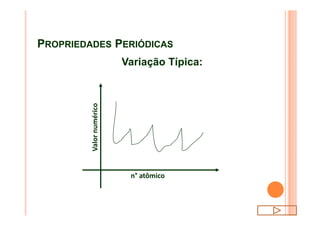
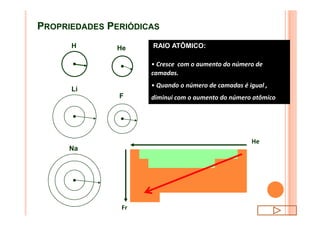
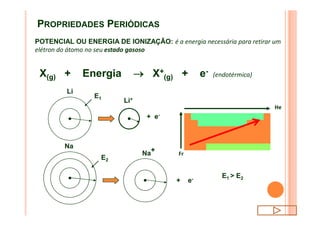
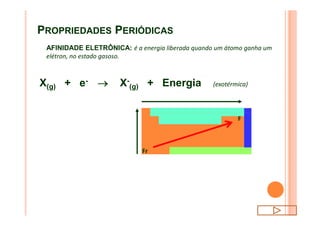
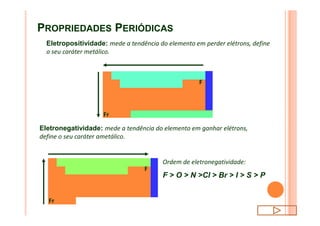
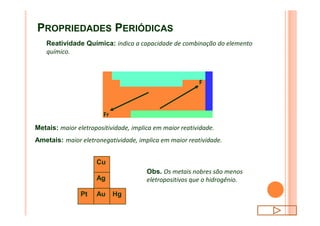
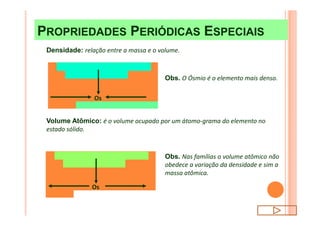
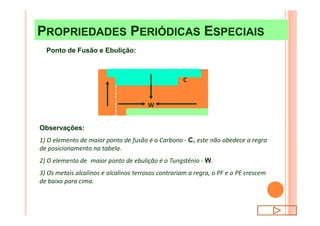
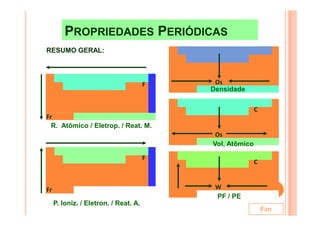
O documento discute a classificação periódica dos elementos, incluindo sua evolução histórica, estrutura da tabela periódica e propriedades periódicas e aperiódicas dos elementos. Apresenta a classificação dos elementos de acordo com seu número atômico e estado físico, e explica como propriedades como raio atômico, potencial de ionização, afinidade elétronica e reatividade variam periodicamente na tabela.