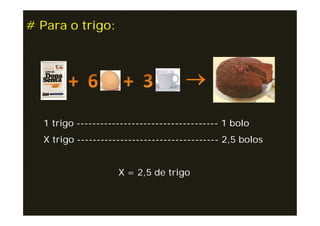
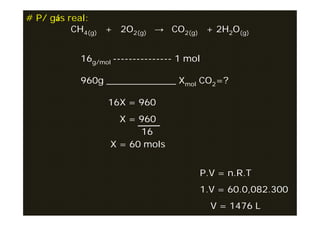
O documento descreve o cálculo estequiométrico, que é o cálculo das quantidades de reagentes e/ou produtos de reações químicas com base nas leis das reações e utilizando a regra de três simples. Exemplos demonstram como calcular quantidades em mol, massa, volume e número de partículas a partir da equação química balanceada e dos dados fornecidos no problema.