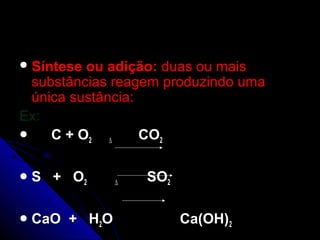
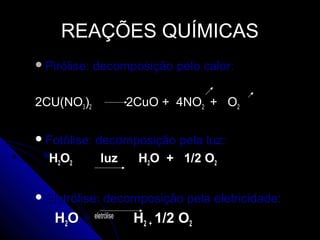
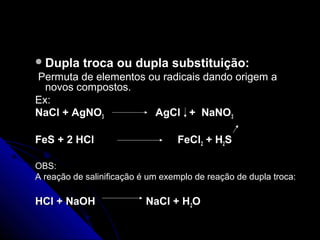
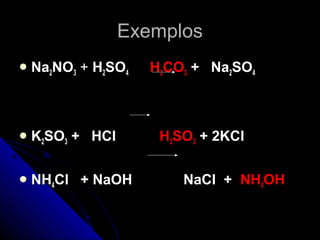
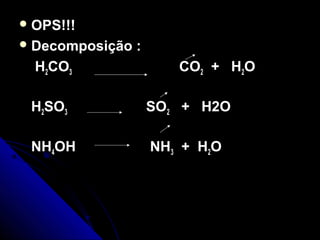
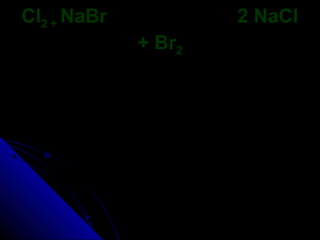
O documento discute conceitos de reações químicas, incluindo representação simbólica de equações químicas, balanceamento de equações, classificação de reações baseadas em liberação de calor e mecanismo, fatores que influenciam reações, e exemplos de reações de deslocamento e dupla troca.