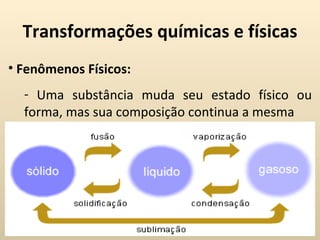
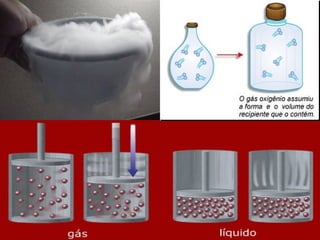
Este documento descreve conceitos fundamentais sobre transformações da matéria, incluindo transformações físicas e químicas, combustão, representações químicas, equações químicas e balanceamento, e modelos atômicos iniciais. Ele também discute as leis das reações químicas, como a lei de Lavoisier e a lei de Proust.