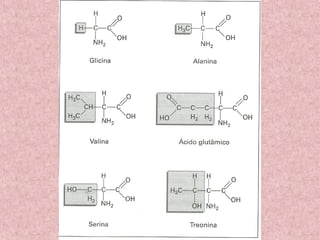
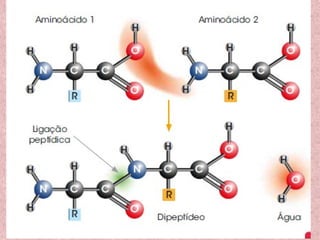
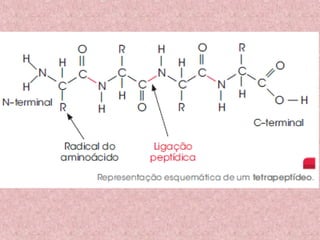
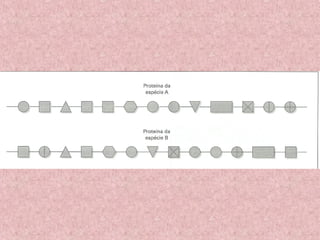
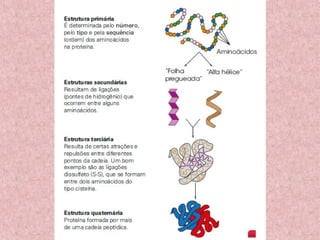
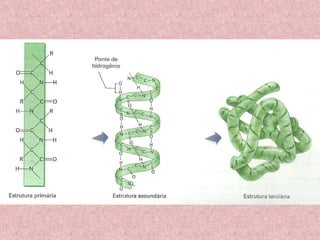
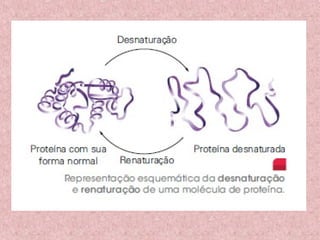
O documento aborda os componentes orgânicos essenciais dos seres vivos, focando nas proteínas e suas funções biológicas, como construção, catálise, defesa, regulação, transporte e coagulação. Explica a estrutura dos aminoácidos, a formação de polipeptídeos, os diferentes níveis estruturais das proteínas e a importância da sequência de aminoácidos para a função proteica. Além disso, discute as diferenças entre autótrofos e heterótrofos em relação à síntese de aminoácidos e a importância das proteínas na dieta.