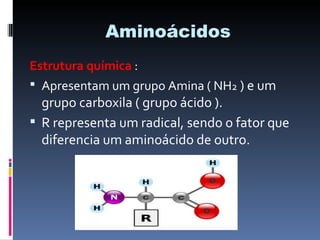
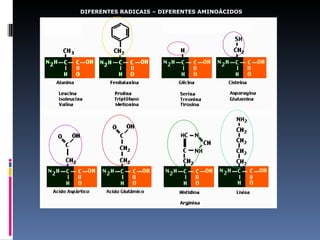
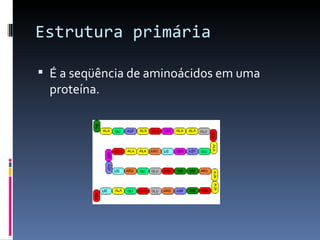
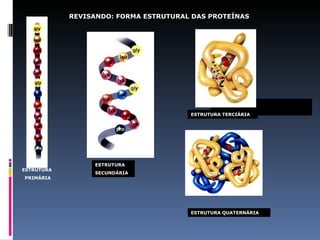
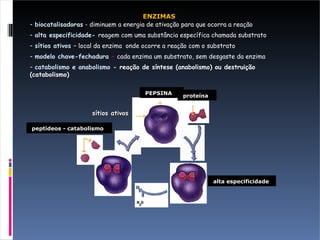
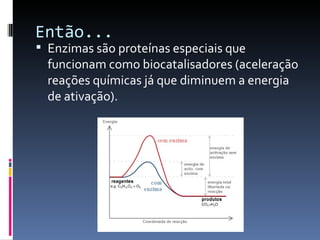
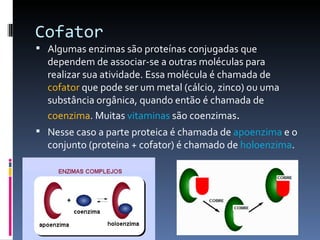
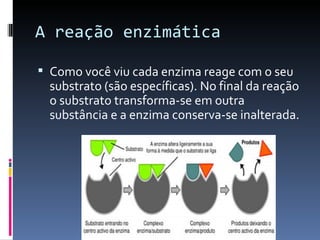
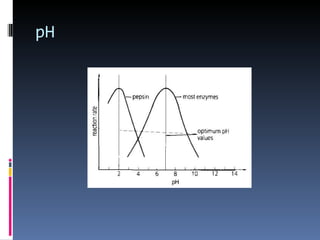
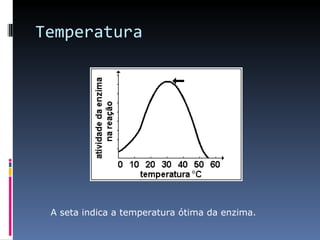
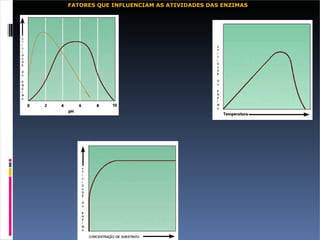
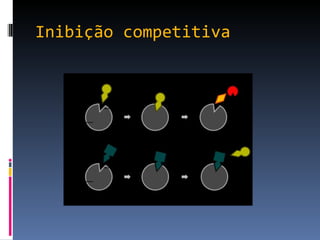
O documento descreve as proteínas, seus componentes (aminoácidos), estrutura e funções. As proteínas são polímeros de aminoácidos unidos por ligações peptídicas. Elas podem ter estrutura primária, secundária, terciária e quaternária. Algumas proteínas especiais chamadas enzimas funcionam como catalisadores de reações químicas no organismo.