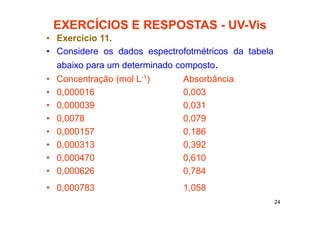
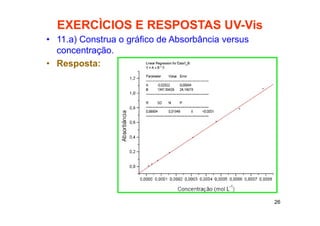
Este documento apresenta 12 exercícios sobre espectroscopia no visível e UV com suas respectivas respostas. Os exercícios abordam conceitos como transmitância, absorbância, absortividade molar e aplicação da lei de Beer-Lambert para cálculo de concentrações.