O documento aborda métodos eletroanalíticos, com foco na potenciometria e condutimetria, suas aplicações em análises químicas e especificidades das reações envolvidas em células eletroquímicas. Discute também a importância do potencial de eletrodo e os tipos de eletrodos utilizados em medições, além de descrever titulações potenciométricas e condutométricas. Por fim, é apresentada a relação entre condutividade e concentração em soluções eletrolíticas, enfatizando a relevância desses métodos na química analítica.




![Introdução aos Métodos Eletroanalíticos Medidas eletroquímicas são freqüentemente específicas para um estado de oxidação particular de um elemento Ce(III) e Ce(IV) método eletroanalítico [Ce] outras técnicas analíticas ◊ ESPECIAÇÃO QUÍMICA◊ Instrumentação relativamente barata R$ 21.000,00 R$ 3.000,00 Femto Modelo 700 plus Digimed Modelo DM-22 Espectrofotômetro UV/VIS pHmetro](https://image.slidesharecdn.com/potenciometriaecondutometria-100412062413-phpapp02/85/Potenciometria-E-Condutometria-5-320.jpg)



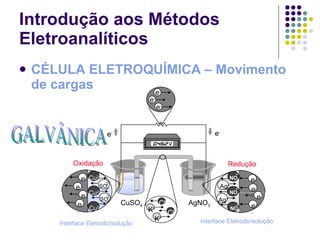
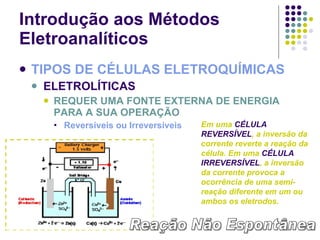
![Introdução aos Métodos Eletroanalíticos UMA CÉLULA ELETROQUÍMICA CONSISTE EM DOIS CONDUTORES CHAMADOS ELETRODOS, CADA UM DELES IMERSO EM UMA SOLUÇÃO ELETROLÍTICA Células Eletroquímicas Ânodo (oxidação) Cátodo (redução) Eletrodo de Cobre e - e - Eletrodo de Prata Ponte Salina (KCl sat.) Cu(s) Cu 2+ + 2e - Ag + + e - Ag(s) [Cu 2+ ] = 1.00 mol/L [Ag + ] = 1.00 mol/L](https://image.slidesharecdn.com/potenciometriaecondutometria-100412062413-phpapp02/85/Potenciometria-E-Condutometria-9-320.jpg)


















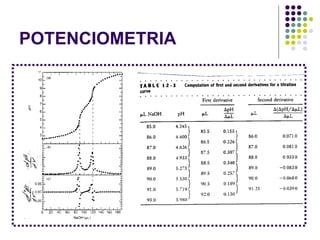
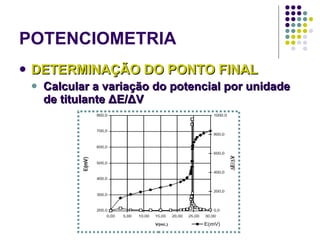
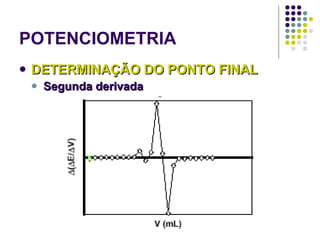

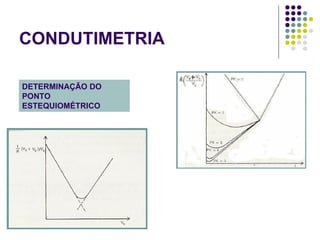
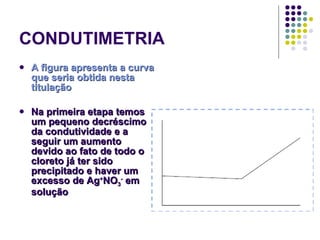
![POTENCIOMETRIA MÉTODO DA ADIÇÃO PADRÃO Mede-se uma série de soluções padrão, para a construção de uma curva de calibração A equação linear do método Y = bo + b1 x X Fica: E(V ou mV) = bo + b1 x Log [analito] Onde o coeficiente de correlação de Pearson (r) será negativo](https://image.slidesharecdn.com/potenciometriaecondutometria-100412062413-phpapp02/85/Potenciometria-E-Condutometria-43-320.jpg)
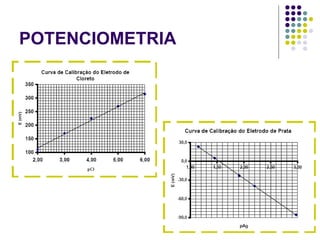
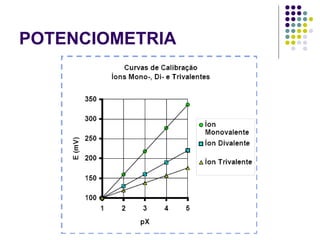
![POTENCIOMETRIA E A = const. – 59,2mV x Log [analito] A E A+P = const. – 59,2mV x Log [analito] A+P Equação:](https://image.slidesharecdn.com/potenciometriaecondutometria-100412062413-phpapp02/85/Potenciometria-E-Condutometria-46-320.jpg)