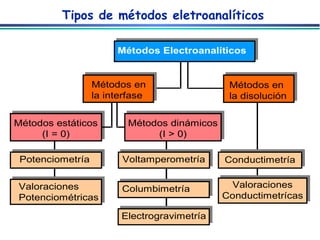
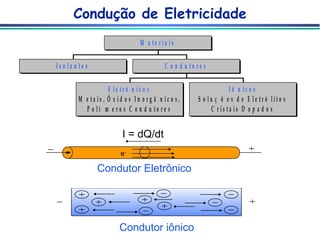
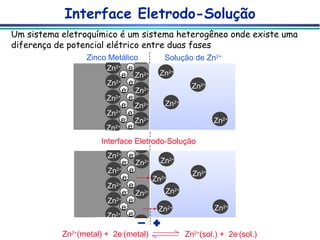
O documento descreve métodos eletroanalíticos, incluindo potenciometria, voltametria e condutimetria. Ele explica propriedades elétricas medidas nestes métodos, tipos de células eletroquímicas, eletrodos de referência e indicadores, e aplicações analíticas destes métodos.



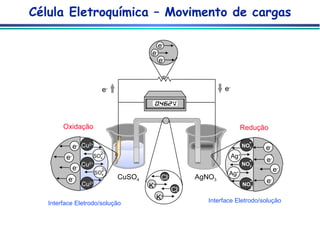
![Célula Eletroquímica Caminho 2: Separar os reagentes em um arranjo apropriado Componentes de uma Célula Eletroquímica 2 condutores imersos em uma solução contendo eletrólitos (eletrodos) 1 condutor eletrônico externo para permitir o fluxo de elétrons 1 condutor iônico para evitar o contato direto dos reagentes e permitir o fluxo de íons Ânodo (oxidação) Cátodo (redução) Eletrodo de Cobre e - e - Eletrodo de Prata Ponte Salina (KCl sat.) Cu(s) Cu 2+ + 2e - Ag + + e - Ag(s) [Cu 2+ ] = 1.00 mol/L [Ag + ] = 1.00 mol/L](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-7-320.jpg)

![atividades vs concentração molar Equação de Nernst atividades Substituição de atividades por concentrações molares somente para soluções diluídas a = [X] coef. atividade Em soluções concentradas, cálculos utilizando-se concentrações molares ao invés de atividades leva a erros consideráveis E REAÇÃO = E 0 REDUÇÃO – 0,0592V xLog a reduzida /a oxidada n](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-11-320.jpg)


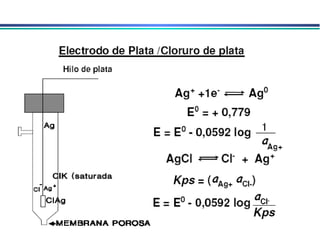
![Eletrodo de prata/cloreto de prata Ag AgCl(sat.), KCl (x mol.L -1 ) Eletrodo de prata imerso em uma solução de KCl saturada com AgCl AgCl(s) + e - Ag(s) + Cl - Podem ser utilizados em T > 60 o C, ao contrário do ECS Quando [Cl - ] = 1molL -1 o potencial do eletrodo é de +0,222V E quando é saturado com KCl o potencial é de +0,197V](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-15-320.jpg)
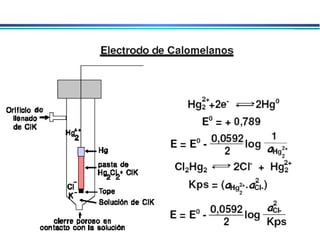
![Eletrodo de calomelano (ESC ou SCE) Eletrodo formado por mercúrio em contato com solução saturada de Hg 2 Cl 2 (calomelano) e que contém uma quantidade conhecida de KCl Hg Hg 2 Cl 2 (sat), KCl (x mol.L -1 ) Hg 2 Cl 2 (s) + 2e - 2Hg(l) + 2Cl - Potencial depende de x Quando [Cl - ] = 1molL -1 o potencial do eletrodo é de +0,268V E quando é saturado com KCl o potencial é de +0,241V](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-17-320.jpg)

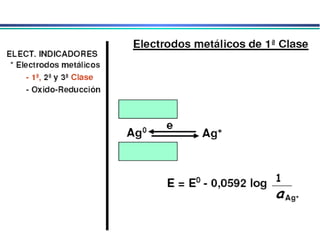

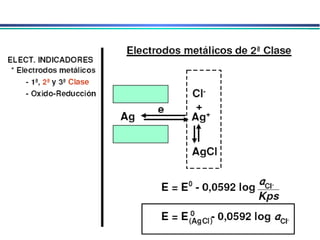
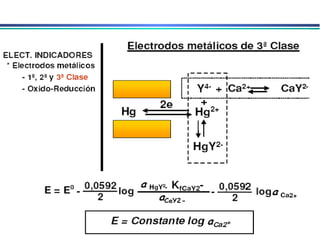
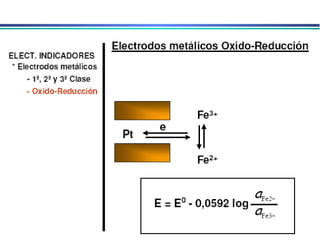
![3. Eletrodos indicadores metálicos do 3o. tipo Eletrodos Indicadores Metálicos Um eletrodo metálico pode, em algumas circunstâncias, responder a cátions diferentes Ex. Eletrodo de mercúrio para determinar a [Ca 2+ ] em solução 4. Eletrodos indicadores metálicos redox Eletrodos de Pt, Au, Pd e metais inertes servem como indicadores em sistemas de oxidação/redução. Eletrodos atuam como fonte para elétrons transferidos de um sistema redox em solução. Ex. Eletrodo de platina em solução contendo Ce 3+ e Ce 4+ E = E o – RT ln aCe 3+ nF aCe 4+](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-23-320.jpg)


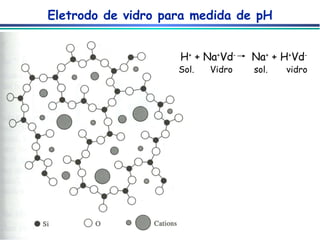
![Eletrodo de vidro para medida de pH medida de pH – medida da diferença de potencial através de uma membrana de vidro que separa a solução desconhecida de uma solução de referencia cuja [H + ] é conhecida pH-metro ESC eletrodo de vidro agitador magnético fio de prata HCl O,1 M saturado c/ AgCl solução de pH desconhecido Fina membrana de vidro (responsável pela resposta ao pH)](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-29-320.jpg)
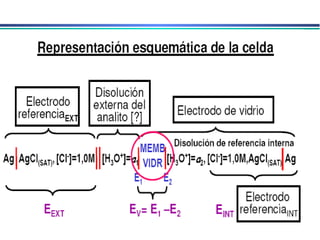
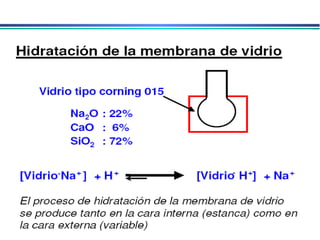
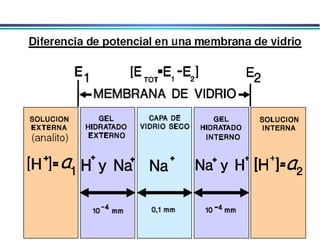

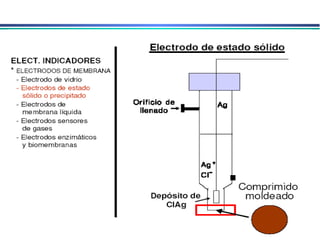
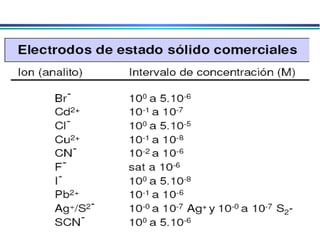
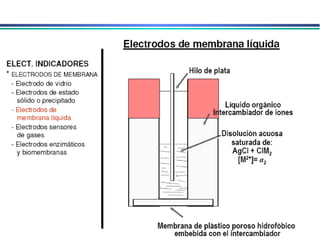

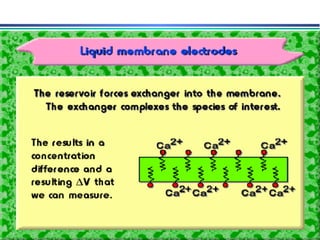

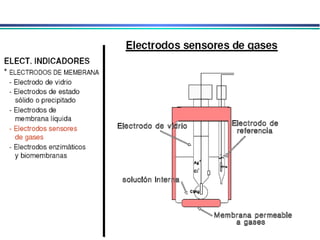

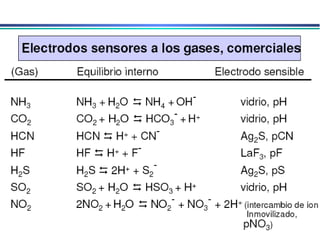
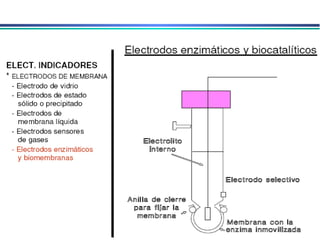
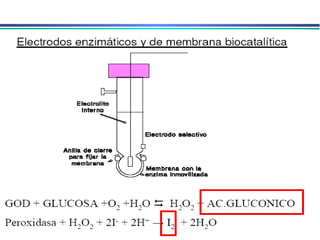
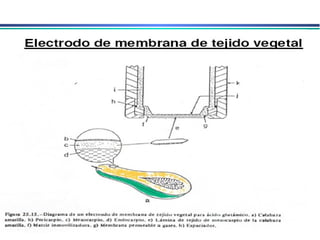
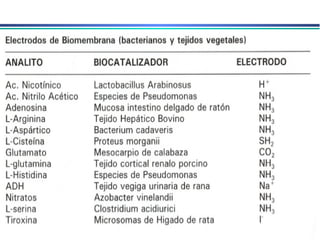

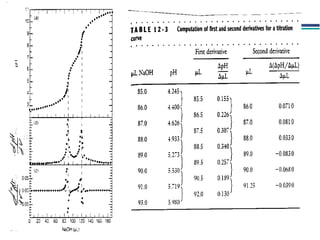

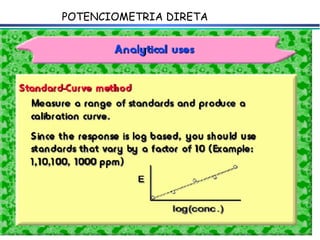
![A equação linear do método OLS Y = bo + b1 x X Fica: E(V ou mV) = bo + b1 x Log [analito] Onde o coeficiente de correlação de Pearson (r) será negativo](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-53-320.jpg)
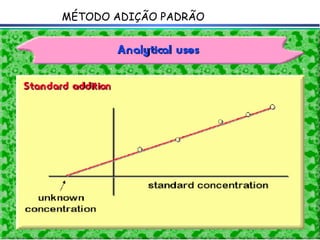
![E A = const. – 59,2mV x Log [analito] A E A+P = const. – 59,2mV x Log [analito] A+P Equação:](https://image.slidesharecdn.com/potenciometria1-110613175045-phpapp01/85/Potenciometria-1-55-320.jpg)