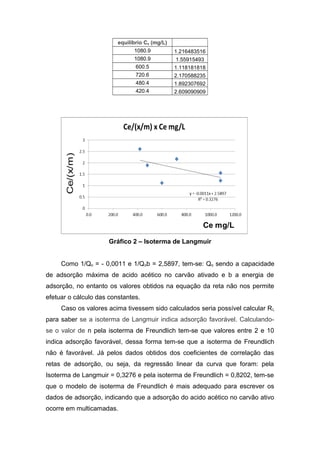
O documento descreve um experimento sobre a adsorção de ácido acético em carvão ativado. Foram traçadas as isotermas de Freundlich e Langmuir e determinadas as constantes de adsorção. A isoterma de Freundlich descreveu melhor os dados, indicando que a adsorção ocorreu em multicamadas.




![Pesou-se 1,23 g de carvão ativado no erlenmeyer, em seguida transferiu-
se a solução de acido acético (0,2 M). Em seguida colocou-se sob agitação por
aproximados 5 minutos e centrifugou-se. Retirou-se um alíquota de 5 mL do
sobrenadante, adicionou-se a um bécher colocando-se mais 45 mL de água
destilada e titulou-se com hidróxido de sódio 1 M, previamente preparado,
utilizando como indicador a fenolftaleína (2 gotas). O mesmo procedimento foi
realizado com as amostras 2, 3, 4, 5 e 6. Os valores encontrados foram
anotados.
4. Resultados e Discussões
Abaixo segue os dados obtidos na titulação com NaOH, que permitiu
encontrar a massa de ácido acético (X) adsorvida no carvão vegetal.
Amostra [HAc]i
Mi HAc
(mg)
VNaOH 0.1M
(mL)
[HAc]f
Mf HAc
(mg)
Concentração no
equilíbrio Ce
(mg/L)
Mi – Mf
X (mg)
1 0.2 1201.0 0.90 0.0018 108.09 1080.9 1092.910
2 0.16 960.8 0.90 0.0018 108.09 1080.9 852.710
3 0.12 720.6 0.50 0.0010 60.05 600.5 660.550
4 0.08 480.4 0.60 0.0012 72.06 720.6 408.340
5 0.06 360.3 0.40 0.0008 48.04 480.4 312.260
6 0.04 240.2 0.35 0.0007 42.035 420.4 198.165
Após obtenção da massa adsorvida foi possível calcular o logaritmo da
razão entre a massa adsorvida (X) e a massa de carvão (m) e o logaritmo da
concentração em equilíbrio de ácido acético.
Amostra X (mg) m (g) X/m log (X/m) log Ce
1 1092.910 1.23 888.54 2.948679288 3.033785517
2 852.710 1.23 693.26 2.840896245 3.033785517
3 660.550 1.23 537.03 2.730000585 2.778513012
4 408.340 1.23 331.98 2.521116813 2.857694258
5 312.260 1.23 253.87 2.404611244 2.681602999
6 198.165 1.23 161.11 2.20712184 2.623611052](https://image.slidesharecdn.com/relatoriodeadsoro11-130924150504-phpapp02/85/Relatorio-de-adsorcao1-1-5-320.jpg)