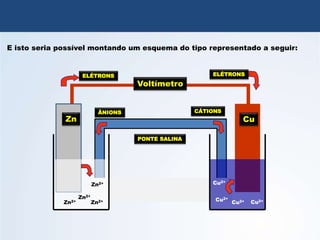
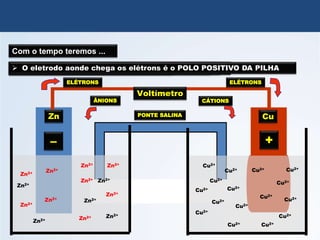
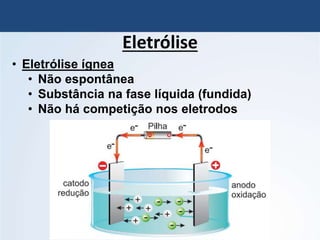
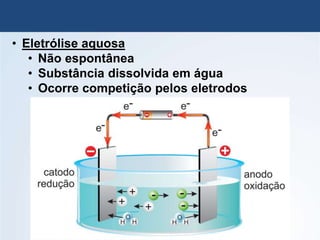
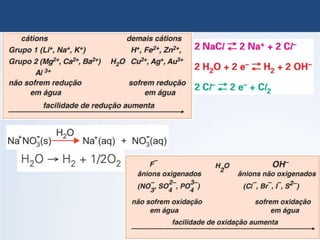
O documento discute a história da pilha elétrica, desde as descobertas iniciais de atração elétrica por fricção até a criação da primeira pilha por Volta. Também explica os princípios da pilha de Daniell e como as reações químicas nela produzem corrente elétrica através da transferência de elétrons.