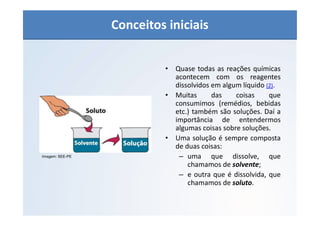
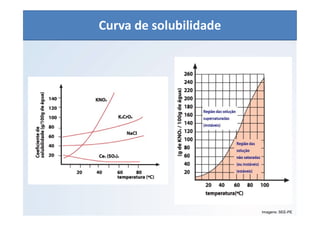
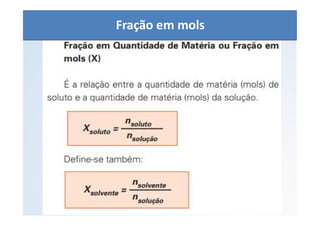
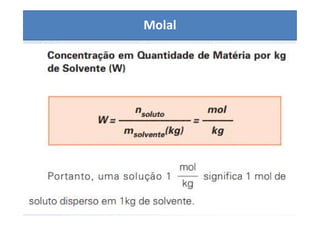
O documento discute os conceitos de concentração de soluções, incluindo concentração comum, concentração molar, soluções saturadas, insaturadas e supersaturadas. Explica como calcular a concentração comum e molar de uma solução e fornece exemplos numéricos.