O documento aborda a aplicação de métodos potenciométricos em análises químicas, ressaltando a calibração de um potenciômetro e a titulação de soluções ácidas. Detalha experimentos práticos para determinar o pH de diferentes amostras e a concentração de ácido clorídrico e ácido acético em vinagre. Os resultados discutem a precisão das medições e os erros potenciais relacionados às técnicas utilizadas.




![5
1. Introdução
Os métodos potenciométricos analíticos instrumentais são usados desde o século 20
para localizar pontos finais em métodos de análises titulométricos, através das
medidas de potenciais de uma célula eletroquímica. Entre os métodos mais
utilizados atualmente, encontram-se aqueles nos quais as concentrações iônicas
são obtidas diretamente do potencial de um eletrodo de membrana seletiva a íons [1].
Diariamente diversas medidas potenciométricas são aplicadas em diferentes usos:
como na medida de pH de muitos produtos comerciais; determinação de gases
sanguíneos em laboratórios clínicos no diagnóstico de doenças; monitoramento de
efluentes industriais e municipais para determinação do pH e a concentração de
poluentes; determinação de dióxido de carbono e outras propriedades relacionadas
a água do mar por oceanógrafos [2]; e servindo também em análises farmacêuticas
no estudo da variação do pH da pele humana [3].
Na potenciometria é necessário um equipamento simples que inclui dois eletrodos
(referência e indicador) e um dispositivo de medida de potencial (potenciômetro).
Enquanto o eletrodo de referência é uma semi-célula que mantém um potencial fixo,
o eletrodo indicador forma com a solução em análise um sistema que responde à
atividade do analito, em sua maioria de acordo com a equação de Nernest.
Desde os anos 30, o método mais conveniente em determinar pH tem sido por
diferença de potencial através de uma membrana de vidro a qual separa a solução
do analito de uma solução de referência, de determinada acidez [1]. Em 1990, Haber
e Klemensiewicz constataram que um bulbo formado por uma fina membrana era
seletivamente permeável a íons H+ e ao se colocar duas soluções, uma no interior e
outra na parte externa do bulbo, se desenvolvia uma diferença de potencial elétrico
através do vidro, cujo valor depende do logaritmo da razão das concentrações do
íon hidrogênio dentro e fora do tubo [4].
O eletrodo de vidro combinado (Figura 1) apresenta compactamente os dois
eletrodos indicador e referência, no qual o primeiro encontra-se envolto pelo
segundo. É o mais utilizado e o mais adequado a aplicações laboratoriais, sendo
mais fácil de manusear que o par de eletrodos separados [5].](https://image.slidesharecdn.com/relatriopotenciometria-150907003729-lva1-app6891/85/Relatorio-Potenciometria-5-320.jpg)
![6
Figura 1: Eletrodo de vidro combinado
A extremidade do bulbo do eletrodo de vidro é constituída por uma membrana (uma
estrutura de silicato em rede com espaços vazios preenchidos por cátions Na+) que,
quando hidratada, forma uma camada de gel externa seletiva aos íons H+. Assim, há
uma reação de troca iônica de íons sódio por hidrogênio que ocorre na superfície do
bulbo (Equação 1) [2], gerando um potencial em função da atividade do íon
hidrogênio.
Equação 1:
2. Objetivos
- Calibrar um potenciômetro e determinar o pH de diferentes amostras, através da
potenciometria direta, utilizando um eletrodo combinado Ag/AgCl;
- Determinar através de uma titulação potenciométrica a concentração de uma
solução de ácido clorídrico;
- Determinar a porcentagem (teor) de ácido acético no vinagre, realizando a titulação
de um ácido fraco com uma base forte por potenciometria.
3. Procedimento](https://image.slidesharecdn.com/relatriopotenciometria-150907003729-lva1-app6891/85/Relatorio-Potenciometria-6-320.jpg)

![8
de titulante foi anotado e com o auxílio da bureta automatizada foram adicionados
incrementos, em porções de 1,00mL, de NaOH (0,09911 mol/L) até atingir 6,00mL
(sempre anotando seus respectivos valores de pH). Incrementos de 0,20mL foram
adicionados até o ponto final e após o mesmo mais 6 outros pontos foram anotados,
finalizando, assim, a titulação potenciométrica.
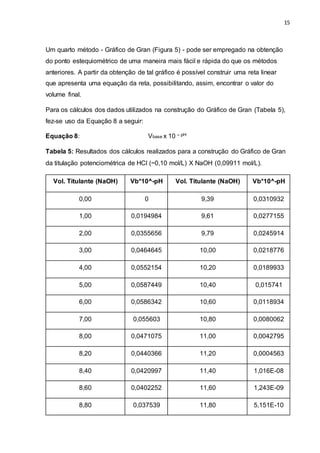
4. Resultados/Tratamento de dados e Discussões
Experimento 1: Calibração do Potenciômetro/ Estudo e determinação do
pH de diferentes amostras
Após a limpeza do eletrodo combinado de vidro do pHmetro, inseriu-se o mesmo na
1ª solução tampão de pH igual a 7,00. Como o valor obtido não foi igual ao pH
esperado (pois o equipamento encontrava-se descalibrado), o eletrodo foi lavado
com água destilada diversas vezes, e submergido na solução, até que o pH
apresentado fosse neutro. Realizou-se procedimento semelhante com a 2ª solução
tampão de pH 4,00, até que o valor obtido fosse bastante próximo a 4,00.
É de extrema importância realizar a calibração de instrumentos de medição pois a
partir dos resultados pode-se assegurar a incerteza inerente ao processo, além de
obter informações válidas que podem ser utilizadas nas correções a serem
realizadas no processo de medição, reduzindo assim os erros [6].
Após a calibração do pHmetro, realizou-se a medição do pH e do potencial de 8
amostras de ác. Clorídrico e hidróxido de sódio, a diferentes concentrações, e de
uma amostra de ác. Acético, os quais estão apresentados abaixo (Tabela 1).
Tabela 1: Valores de pH, potencial (mV) e temperatura (°C) de amostras de ácido
acético, HCl e NaOH a diferentes concentrações obtidos experimentalmente através
de um aparelho de pHmetro.
Amostras pH Teórico pH Medido Potencial
(mV)
Temperatura
(°C)
HCl 1 mol/L 0,00 0,07 385 25,5
HCl 0,1086 mol/L 0,96 0,95 334 25,5
HCl 0,01 mol/L 2,00 3,11 208 25,9](https://image.slidesharecdn.com/relatriopotenciometria-150907003729-lva1-app6891/85/Relatorio-Potenciometria-8-320.jpg)
![9
HCl 0,001 mol/L 3,00 3,06 212 25,7
H3CCOOH 0,10
mol/L
2,88 2,71 231 25,4
NaOH 1,0 mol/L 14,00 13,10 -370 25,1
NaOH 0,1050
mol/L
13,02 12,56 -340 25,4
NaOH 0,1 mol/L 13,00 12,66 -347 25,3
NaOH 0,01 mol/L 12,00 12,36 -329 25,4
Através das seguintes equações foi possível calcular os valores de pH teóricos para
as soluções ácidas e básicas acima, respectivamente:
Equação 2: pH = - log [H+]
Equação 3: pOH = 14 – pH
Para o cálculo do pH teórico do Ácido Acético foi preciso utilizar o valor de sua
constante de ionização, portanto, também se fez necessário o uso da equação
abaixo para obter tal resultado:
Equação 4: Ka =
[ 𝐴−][𝐻+]
[𝐴𝐻]
Sendo, Ka = 1,75x10-5 [7] (Constante de ionização do ácido acético.)
[A-] = [H+]
[AH] = 0,10 mol/L
1,75x10-5 = [H+]2/0,10
[H+] = 0,00132 mol/L
Aplicando o resultado na eq. 1: pH = - log 0,00132
pH = 2,88
Comparando os resultados de pH experimentais com os teóricos das soluções de
HCl 1,0, 0,01 e 0,001 mol/L pode-se perceber que houve uma ligeira diferença entre
os mesmos. Tal fato possivelmente deve-se à não padronização das amostras, ou
seja, os valores em mol/L das soluções se diferenciavam das concentrações reais
das mesmas.](https://image.slidesharecdn.com/relatriopotenciometria-150907003729-lva1-app6891/85/Relatorio-Potenciometria-9-320.jpg)
![10
Já a solução de HCl 0,1086 mol/L apresentou valores de pH teórico e experimental
bastante próximos (0,96 e 0,95 respectivamente), o que condiz com a informação do
rótulo da amostra de que a mesma estava padronizada.
Diferentemente dos ácidos, os valores de pH obtidos experimentalmente das
amostras de hidróxido de sódio diferenciaram-se consideravelmente dos valores
teóricos, incluindo a solução padronizada. Tal dissemelhança não está apenas
associada às concentrações das amostras, mas deve-se também ao “erro alcalino”.
Em meios altamente alcalinos, as concentrações de íon hidrogênio é extremamente
inferior às concentrações de íons sódio; com a deficiência do primeiro, a troca iônica
acaba também sendo realizada pelos íons Na+ das soluções, já que possuem
mesma carga e tamanho próximo aos íons H+.
Como pôde-se observar em três dos resultados acima, o erro é negativo (os valores
de pH medidos foram mais baixos do que os valores esperados), o que indica que o
aparelho respondeu tanto a íons sódio como aos prótons. Tal erro alcalino é
explicado considerando um equilíbrio de troca entre os íons hidrogênio na superfície
do bulbo do eletrodo e os cátions na solução (Equação 5) [2].
Equação 5:
O processo descrito acima é inverso ao da Equação 1, onde B+ representa um íon
monovalente, como o sódio. Neste, a atividade dos íons Na+ em relação à de íons
H+ é tão grande que o eletrodo responde a ambas as espécies [1].
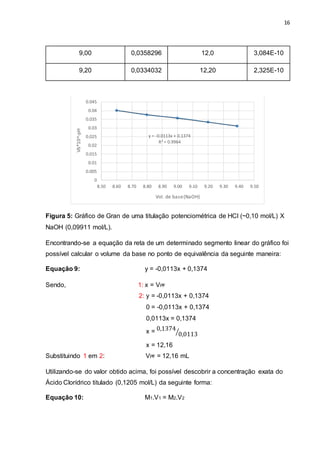
Experimento 2: Titulação Potenciométrica de uma solução de Solução
de Ácido Clorídrico/ Determinação da acidez do vinagre por titulação
potenciométrica
Realizou-se a titulação potenciométrica de uma solução de ácido clorídrico (~ 0,10
mol/L) com uma solução padronizada de NaOH (0,09911 mol/L), a partir de uma
bureta automática e um eletrodo combinado de vidro. As medições de pH a cada
respectivo volume adicionado de base estão listadas na tabela a seguir:](https://image.slidesharecdn.com/relatriopotenciometria-150907003729-lva1-app6891/85/Relatorio-Potenciometria-10-320.jpg)
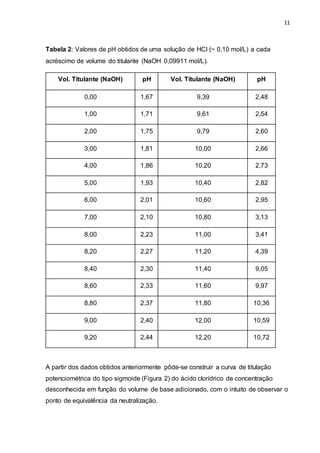
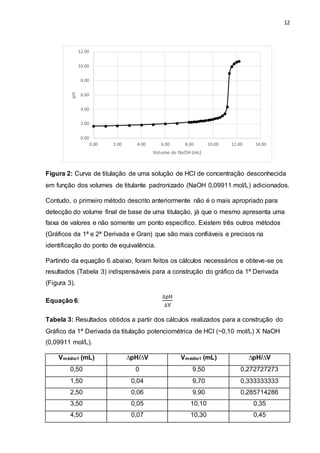
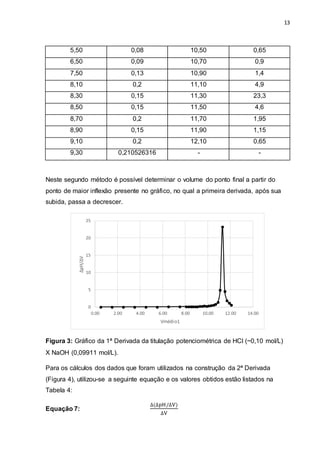
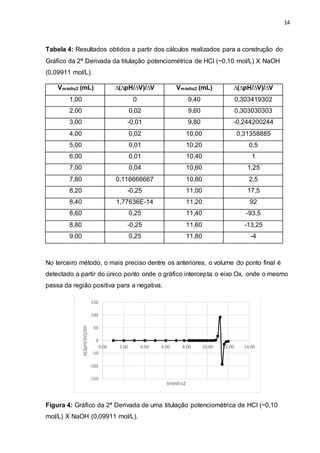

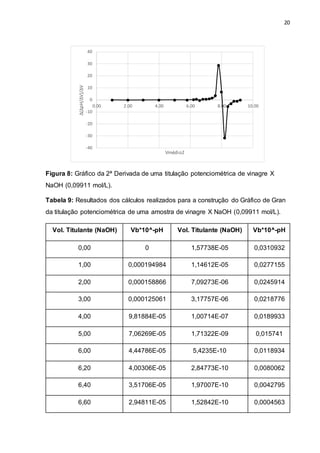
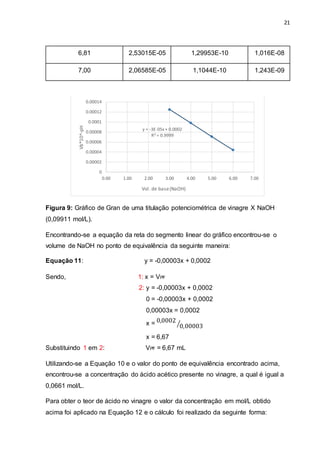
![22
Equação 12: C = M. MM
Onde: MM (ácido acético) = 60,5 g/mol
C = 0,0661x60,5
C = 3,9991 g/L
Desta maneira, encontrou-se o percentual em m/V do ácido acético presente no
vinagre, igual a 3,9991%, ou aproximadamente 4%. Tal valor condiz com as
especificações da legislação Brasileira que estabelece 4% como teor mínimo de
ácido acético para vinagre e 4 a 6 a porcentagem do ácido que se deve conter no
vinagre para consumo [8].
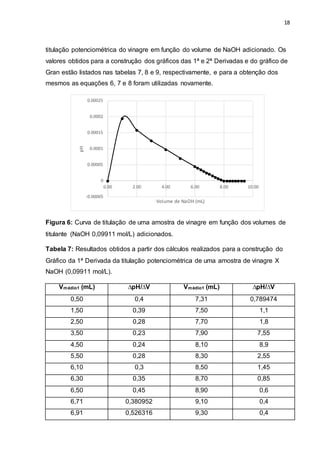
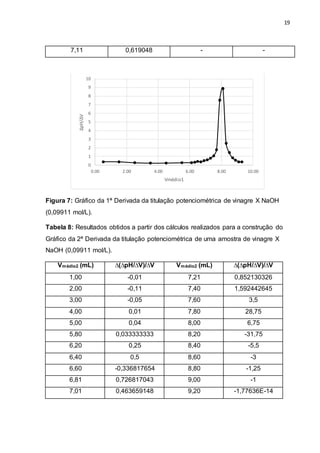
Comparando-se as curvas de titulação de ambas as amostras (Figuras 2 e 6), é
possível observar que a curva do HCl apresenta maior inflexão comparada à curva
da amostra de vinagre. Sabendo-se que grande parte do vinagre é composta pelo
ácido acético, o fato observado pode ser explicado pela força ácida dos mesmos. É
sabido que quanto maior a força do ácido ou base, ou sua concentração em solução,
maior será o salto potenciométrico; tal fato foi o que se constatou
experimentalmente, já que o ácido clorídrico é muito mais forte do que o Acético.
5. Conclusão
Através de tais experimentos, foi possível calibrar um potenciômetro e com isso
determinar o pH de diferentes amostras ácidas e básicas através da potenciometria
direta. Além disso, com a execução de duas titulações potenciométricas, também foi
realizável a determinação da concentração de uma solução de ácido clorídrico e do
teor de ácido acético no vinagre, podendo assim compará-los com base nos perfis
de suas respectivas curvas potenciométricas.
6. Referências
[1] – SKOOG, HOLLER, NIEMAN, Princípios de Análise Instrumental, 5ª Edição,
Editora Bookman, São Paulo-SP, 2002.](https://image.slidesharecdn.com/relatriopotenciometria-150907003729-lva1-app6891/85/Relatorio-Potenciometria-22-320.jpg)
![23
[2] – SKOOG, WEST, HOLLER, CROUCH, Fundamentos de Química Analítica,
Tradução da 8ª Edição norte-americana, Editora Thomson, São Paulo-SP, 2006.
[3] – Disponível em: http://www.scielo.br/pdf/%0D/abd/v77n5/en_v77n5a06.pdf.
Acesso em: 20 de julho de 2015.
[4] – Disponível em:
http://analiticaqmc20132.paginas.ufsc.br/files/2013/11/potenciometria-rev.pdf.
Acesso em: 17 de julho de 2015.
[5] – FERNANDES, C. Estudo e determinação do pH. Disponível em:
http://www.dec.ufcg.edu.br/saneamento/PH.html. Acesso em: 17 de julho de 2015.
[6] – Disponível em: http://www.agsolve.com.br/dicas-e-solucoes/a-importancia-da-
calibracao-e-manutencao-de-equipamentos. Acesso em: 26 de julho de 2015.
[7] – HARRIS, D. C.; Análise Analítica Quantitativa; 6. Ed. Rio de Janeiro, RJ: LTC;
2005.
[8] – Disponível em:
http://sistemasdeproducao.cnptia.embrapa.br/FontesHTML/Vinagre/SistemaProduca
oVinagre/composicao.htm. Acesso em: 26 de julho de 2015.](https://image.slidesharecdn.com/relatriopotenciometria-150907003729-lva1-app6891/85/Relatorio-Potenciometria-23-320.jpg)