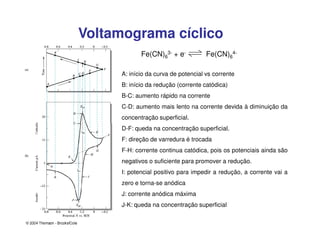
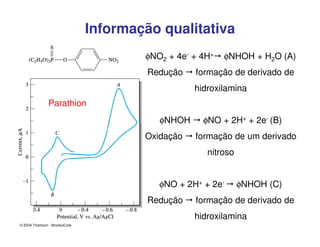
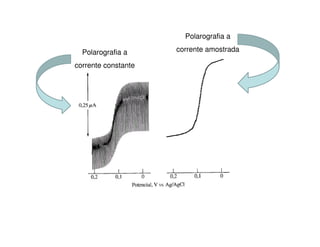
1. O documento descreve diferentes métodos voltamétricos como a polarografia e discute seu histórico, princípio e aplicações.
2. A polarografia foi desenvolvida por Heyrowsky em 1922 usando uma célula de dois eletrodos com um eletrodo gotejante de mercúrio.
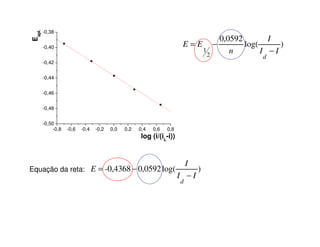
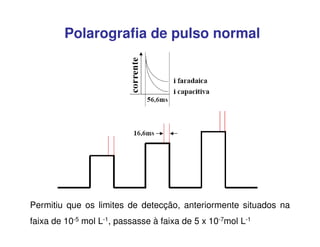
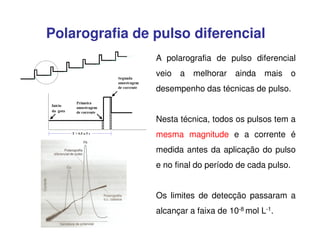
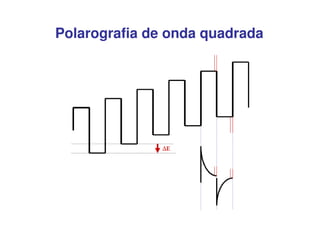
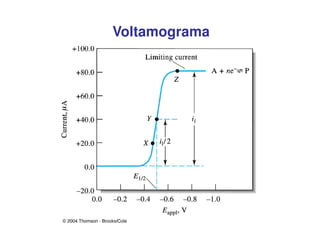
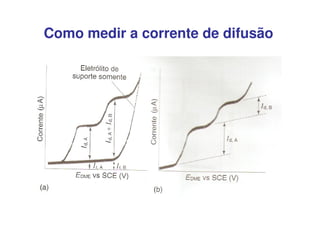
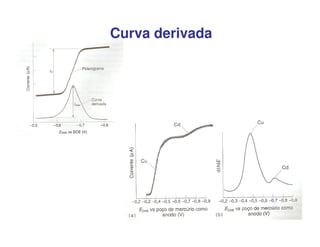
3. A equação da polarografia relaciona a corrente de difusão à concentração da espécie eletroativa, permitindo quantificar analitos.














![Polarograma
Cd2+ + 2e-
Cd
E = Eo −
0,0592
[Re d ]
log(
)
n
[Ox]](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-16-320.jpg)







![Potencial de meia-onda
Quanto ao potencial de meia-onda, E1/2, trata-se de um parâmetro oriundo da
equação de Nernst aplicada à polarografia.
Ox + ne-
Red
A equação de Nernst para esta reação no sentido da redução (onda
polarográfica catódica), a 250C, adquire a forma
E = E0 −
0,0592
a
log( red )
n
aox
Para a espécie oxidada :
i = k ([Ox] − [Ox]i )
i = k[Ox] = id
[Ox]i = (id − i ) / k](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-24-320.jpg)
![Potencial de meia-onda
Quanto ao potencial de meia-onda, E1/2, trata-se de um parâmetro oriundo da
equação de Nernst aplicada à polarografia.
Ox + ne-
Red
A equação de Nernst para esta reação no sentido da redução (onda
polarográfica catódica), a 250C, adquire a forma
E = E0 −
0,0592
a
log( red )
n
aox
Para a espécie oxidada :
i = k ([Ox] − [Ox]i )
i = k[Ox] = id
[Ox]i = (id − i ) / k
Para a espécie reduzida :
i = k[Re d ]i
[Re d ]i = i / k](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-25-320.jpg)
![Potencial de meia-onda
Quanto ao potencial de meia-onda, E1/2, trata-se de um parâmetro oriundo da
equação de Nernst aplicada à polarografia.
Ox + ne-
Red
A equação de Nernst para esta reação no sentido da redução (onda
polarográfica catódica), a 250C, adquire a forma
E = E0 −
0,0592
a
log( red )
n
aox
0,0592
i/k
E=E −
log(
)
n
(id − i ) / k
0
0,0592
id − i
E=E +
log(
)
n
i
0
Para a espécie oxidada :
i = k ([Ox] − [Ox]i )
i = k[Ox] = id
[Ox]i = (id − i ) / k
Para a espécie reduzida :
i = k[Re d ]i
[Re d ]i = i / k](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-26-320.jpg)
![Potencial de meia-onda
Quanto ao potencial de meia-onda, E1/2, trata-se de um parâmetro oriundo da
equação de Nernst aplicada à polarografia.
Ox + ne-
Red
A equação de Nernst para esta reação no sentido da redução (onda
polarográfica catódica), a 250C, adquire a forma
E = E0 −
0,0592
a
log( red )
n
aox
0,0592
i/k
E=E −
log(
)
n
(id − i ) / k
0
0,0592
id − i
E=E +
log(
)
n
i
0
Quando i = id / 2 ⇒ E = E1/2
Para a espécie oxidada :
i = k ([Ox] − [Ox]i )
i = k[Ox] = id
[Ox]i = (id − i ) / k
Para a espécie reduzida :
i = k[Re d ]i
[Re d ]i = i / k
id − i
0,0592
E = E1/ 2 +
log(
)
n
i](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-27-320.jpg)






![Método da adição padrão
Uma solução contendo Cd2+ foi analisada por polarografia empregando-se o método da adição de
padrão. 25 mL de uma solução desaerada contendo a amostra e 1 mol L-1 de HNO3 produz uma
corrente de 1,78 µA (E = -0,85 V vs ECS). Posteriormente, com a adição de 5,00 mL de uma
solução padrão 2,25x10-3 mol L-1 de Cd2+, a mistura resultante produziu uma corrente de 4,48 µA.
Calcule a concentração do Cd2+ na amostra.
2+
1,78µA = k .[Cd ] (25mL)](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-37-320.jpg)
![Método da adição padrão
Uma solução contendo Cd2+ foi analisada por polarografia empregando-se o método da adição de
padrão. 25 mL de uma solução desaerada contendo a amostra e 1 mol L-1 de HNO3 produz uma
corrente de 1,78 µA (E = -0,85 V vs ECS). Posteriormente, com a adição de 5,00 mL de uma
solução padrão 2,25x10-3 mol L-1 de Cd2+, a mistura resultante produziu uma corrente de 4,48 µA.
Calcule a concentração do Cd2+ na amostra.
1,78µA = k .[Cd 2+ ] (25mL)
25
5
2+
4,48µA = k .( .[Cd ] + .2,25 x10 −3 )
30
30](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-38-320.jpg)
![Método da adição padrão
Uma solução contendo Cd2+ foi analisada por polarografia empregando-se o método da adição de
padrão. 25 mL de uma solução desaerada contendo a amostra e 1 mol L-1 de HNO3 produz uma
corrente de 1,78 µA (E = -0,85 V vs ECS). Posteriormente, com a adição de 5,00 mL de uma
solução padrão 2,25x10-3 mol L-1 de Cd2+, a mistura resultante produziu uma corrente de 4,48 µA.
Calcule a concentração do Cd2+ na amostra.
1,78µA = k .[Cd 2+ ] (25mL)
25
5
2+
4,48µA = k .( .[Cd ] + .2,25 x10 −3 )
30
30
1,78
[Cd 2+ ]
=
⇒ [Cd 2+ ] = 2,23x10 − 4 molL−1
4,48 (0,83.[Cd 2+ ] + 3,75 x10 − 4 )](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-39-320.jpg)

![Método do padrão interno
O clorofórmio é um padrão interno na determinação do pesticida DDT em uma análise polarográfica
na qual cada composto é reduzido na superfície de um eletrodo. Uma mistura contendo clorofórmio
a 0,500 mmol L-1 e DDT a 0,8 mmol L-1 fornece sinais de 15,3 µA para o clorofórmio e 10,1 µA para
o DDT. Uma solução desconhecida (10,0 mL) contendo DDT foi colocada em um balão volumétrico
de 100 mL e foram adicionados 10,2 µL de clorofórmio (PM 119,39, densidade = 1,484 g mL-1). Após
a diluição a marca de aferição com solvente, foram observados os sinais polarográficos de 29,4 e
8,7 µA para o clorofórmio e DDT, respectivamente. Encontre a concentração de DDT na amostra
desconhecida.
15,3
0,5
= k.
⇒ k = 2,42
10,1
0,8
m nPM
d= =
= C.PM ⇒ 1,484 = C.119,39 ⇒ [clorofórmio]I = 12,42molL−1
V
V](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-41-320.jpg)
![Método do padrão interno
O clorofórmio é um padrão interno na determinação do pesticida DDT em uma análise polarográfica
na qual cada composto é reduzido na superfície de um eletrodo. Uma mistura contendo clorofórmio
a 0,500 mmol L-1 e DDT a 0,8 mmol L-1 fornece sinais de 15,3 µA para o clorofórmio e 10,1 µA para
o DDT. Uma solução desconhecida (10,0 mL) contendo DDT foi colocada em um balão volumétrico
de 100 mL e foram adicionados 10,2 µL de clorofórmio (PM 119,39, densidade = 1,484 g mL-1). Após
a diluição a marca de aferição com solvente, foram observados os sinais polarográficos de 29,4 e
8,7 µA para o clorofórmio e DDT, respectivamente. Encontre a concentração de DDT na amostra
desconhecida.
15,3
0,5
= k.
⇒ k = 2,42
10,1
0,8
m nPM
= C.PM ⇒ 1,484 = C.119,39 ⇒ [clorofórmio]I = 12,42molL−1
d= =
V
V
12,42 x10,2 x10 −6
[clorofórmio]adicKamostra =
1,27mmolL−1
0,1](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-42-320.jpg)
![Método do padrão interno
O clorofórmio é um padrão interno na determinação do pesticida DDT em uma análise polarográfica
na qual cada composto é reduzido na superfície de um eletrodo. Uma mistura contendo clorofórmio
a 0,500 mmol L-1 e DDT a 0,8 mmol L-1 fornece sinais de 15,3 µA para o clorofórmio e 10,1 µA para
o DDT. Uma solução desconhecida (10,0 mL) contendo DDT foi colocada em um balão volumétrico
de 100 mL e foram adicionados 10,2 µL de clorofórmio (PM 119,39, densidade = 1,484 g mL-1). Após
a diluição a marca de aferição com solvente, foram observados os sinais polarográficos de 29,4 e
8,7 µA para o clorofórmio e DDT, respectivamente. Encontre a concentração de DDT na amostra
desconhecida.
15,3
0,5
= k.
⇒ k = 2,42
10,1
0,8
29,4
1,27
m nPM
= 2,42.
= C.PM ⇒ 1,484 = C.119,39 ⇒ [clorofórmio]I = 12,42molL−1
d= =
[ DDT ]
8,7
V
V
12,42 x10,2 x10] 6 0,9090mmolL−1 (100mL)
[ DDT − =
[clorofórmio]adicKamostra =
1,27mmolL−1
0,1
Diluição10 x → [ DDT ]
= 9,09mmolL−1
amostra](https://image.slidesharecdn.com/aula-6-voltametria-131209135420-phpapp02/85/Aula-6-voltametria-43-320.jpg)